
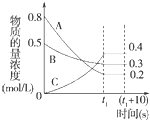
 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 2C.
2C.分析 (1)根据图象中A、B、C浓度的变化趋势判断反应物和生成物,根据浓度变化之比等于化学剂量数之比确定反应的化学方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率;
(3)根据总浓度与平衡时总浓度之比等于压强之比计算;
(4)(t1+10)s时,各物质的浓度不变,平衡没有移动;
(5)a.到达t1时刻达到平衡状态;
b.在t1时刻之前反应正向进行;
c.在t1时刻达到平衡状态;
d.在t1时刻达到平衡时正逆反应速率相同.
解答 解:(1)由图象可知,在反应中,A的浓度逐渐减小,B、C的浓度逐渐增大,则A、B为反应物,C为生成物,相同时间内浓度的变化比值为c(A):c(B):c(C)=(0.8-0.2):(0.5-0.3):0.4=3:1:2,化学反应中浓度变化之比等于化学剂量数之比,则化学方程式为3A+B 2C,
2C,
故答案为:3A+B 2C;
2C;
(2)反应从开始进行至时间t1,用气体A浓度变化表示的该反应的反应速率为:v=$\frac{△c}{△t}$=$\frac{0.8mol/L-0.2mol/L}{{t}_{1}}$=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1,
故答案为:$\frac{0.6}{{t}_{1}}$mol•L-1•min-1;
(3)反应前总的浓度为0.8+0.5=1.3mol/L,平衡时总浓度为0.2+0.3+0.4=0.9mol/L,则反应后与反应前的压强之比为$\frac{1.3}{0.9}$=$\frac{13}{9}$,
故答案为:$\frac{13}{9}$.
(4)(t1+10)s时,各物质的浓度不变,A气体的体积分数为$\frac{0.2}{0.2+0.3+0.4}$=$\frac{2}{9}$,平衡没有移动,所以v(A)正=v(B)逆;
故答案为:$\frac{2}{9}$;=;
(5)a.到达t1时刻达到平衡状态,正逆反应速率相同,但是速率不为零,故a错误;
b.在t1时刻之前反应正向进行,则B气体的消耗速率大于它的生成速率,故b正确;
c.在t1时刻达到平衡状态,C气体的正反应速率等于逆反应速率,故c正确;
d.在t1时刻达到平衡时正逆反应速率相同,各物质的浓度保持不变,故d错误.
故答案为:bc.
点评 本题考查了根据图象写方程式、化学反应速率的计算及化学平衡移动,难度中等,解题关键是准确分析图表.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代烃都可发生取代反应 | |
| B. | 由2-氯丙烷制取少量的1,2-丙二醇时,只需要经过取代反应、水解反应 | |
| C. | 实验室制硝基苯时,正确的操作顺序应该是先加入苯,再滴加浓硫酸,最后滴加浓硝酸 | |
| D. | 2-甲基-2-丁烯可以形成顺反异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4.6 g NO2与N2O4的混合物中含有的N原子数为0.1NA | |
| B. | 常温常压下,22.4 L NO的分子数为0.1NA | |
| C. | 将0.3mol NO2溶于水,完全反应后,转移的电子数为0.2 NA | |
| D. | 1L0.1mol•L-1 氨水中含有的NH3分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、甲酸钠溶液、乙酸乙酯 | D. | 苯乙烯、苯酚、乙苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 电解熔融氯化钠时,钠离子被还原为钠 | |
| C. | 钠是一种灰黑色的固体 | |
| D. | 钠的质地软,熔点低于100℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com