
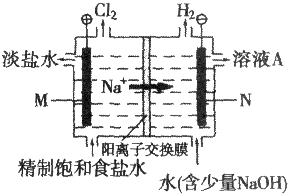
分析 (1)依据装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,则M为石墨,右边为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,则N为铁;
(2)电解饱和食盐水,依据电极反应判断生成产物,书写离子方程式;
(3)根据阳极产物和平衡移动原理分析;
解答 解:(1)依据装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,则M为石墨,反应式为:2Cl--2e-=Cl2↑,右边为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,则N为铁,故答案为:铁;2Cl--2e-=Cl2↑;
(2)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-;
(3)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O?HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
故答案为:Cl2与水的反应为Cl2+H2O?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;
点评 本题考查了电解池原理的分析应用,主要是电极反应,电极判断,离子除杂实验设计方案分析判断是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

 ,B中含有的化学键类型是离子键、共价键.
,B中含有的化学键类型是离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA | |
| B. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 在电解食盐水的实验中,测得阴极析出的气体的分子数为0.5NA,则电解后溶液的pH为14 | |
| D. | 64g的铜发生氧化还原反应,一定失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | 稀盐酸、BaCl2溶液 | ||
| C. | 稀硝酸、BaCl2溶液 | D. | 稀硫酸、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| C. | 工作一段时间后,电解液中的KOH的物质的量不变 | |
| D. | 工作时溶液中K+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④①⑤② | B. | ③①④②⑤ | C. | ③②①⑤④ | D. | ③④①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com