
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 室温下,NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液 |
分析 A、向铁粉中加入稀硝酸,先生成硝酸铁,若铁过量会继续反应生成硝酸亚铁;
B、向稀盐酸中滴入少量的NaAlO2溶液,生成的氢氧化铝溶液过量盐酸,溶质是氯化铝和氯化钠的混合物;
C、向MgSO4、H2SO4的混合液中滴入过量的Ba(OH)2溶液,会生成难溶的氢氧化镁沉淀和硫酸钡沉淀,最终剩余为Ba(OH)2溶液;
D、NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液,溶质可能是醋酸钠,或者是醋酸钠和氢氧化钠的混合物;
解答 解:A、向铁粉中加入稀硝酸,先生成硝酸铁,若铁过量会继续反应生成硝酸亚铁,所以根据铁用量的多少可以生成硝酸铁和硝酸亚铁混合物,故A错误;
B、向稀盐酸中滴入少量的NaAlO2溶液,溶质是氯化铝和氯化钠的混合物,故B错误;
C、向MgSO4、H2SO4的混合液中滴入过量的Ba(OH)2溶液,会生成难溶的氢氧化镁沉淀和硫酸钡沉淀,最终剩余为Ba(OH)2溶液,一定是一种溶质,故C正确;D、NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液,溶质可能是醋酸钠,或者是醋酸钠和氢氧化钠的混合物,故D错误;
故选C.
点评 本题考查了物质定量反应的产物判断、盐类水解分析、氧化还原反应等知识点,主要是氢氧化铝是两性氢氧化物溶于强酸强碱,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
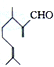 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(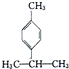 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 对异丙基甲苯的分子式为C10H14 | |
| B. | 香叶醛的一种同分异构体可能是芳香醇 | |
| C. | 两者互为同分异构体 | |
| D. | 两者均能与溴水反应加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合所得溶液的pH<7 | |
| B. | 反应2CO(g)+2H2(g)→CH3COOH (l)的△S>0 | |
| C. | 冰醋酸用水稀释,溶液中c(H+)先变大后变小 | |
| D. | 含有CH3COOH、C2H5OH、CH3COOC2H5及H2O的平衡体系中加入少量浓硫酸,CH3COOC2H5的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
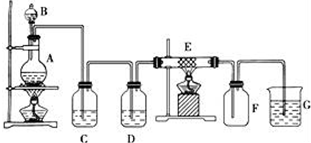
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验装置 | 现象 |
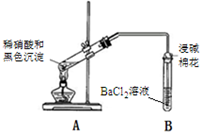 | 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现红棕色气体 3B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+ Ba2+ SiO32- NO3- | |
| B. | 氨气:K+ Na+ AlO2- CO32- | |
| C. | 二氧化硫:Na+ NH4+ SO32- C1- | |
| D. | 甲醛:Ca2+ Mg2+ Mn04- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
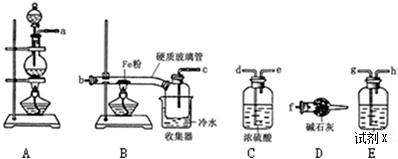
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com