
【题目】下列物质受热不易分解的氢氧化物是( )
A.Al(OH)3 B.NaOH
C.Mg(OH)2 D.Fe(OH)3
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是

A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期律的叙述中,正确的是
A. 氧化性强弱:F2<Cl2
B. 金属性强弱:K<Na
C. 酸性强弱:H3PO4<H2SO4
D. 碱性强弱:NaOH<Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
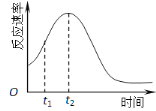 (5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列说法中正确的是
A.5.6 g Fe和足量的氯气完全反应失去电子数为0.2NA
B.标准状况下,11.2L CCl4所含的分子数为0.5NA
C.0.5 molL﹣1AlCl3溶液中Cl﹣的数目为1.5NA
D.17g氨气中含有的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子,其M层与K层电子数相同;元素Y的原子,其M层上有7个电子.X和Y所形成的稳定化合物的相对分子质量为( )
A.100
B.95
C.88
D.80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每空分共(1)现有①硫酸②酒精③液氨④纯碱⑤熔融的氢氧化钠⑥水银⑦三氧化硫⑧澄清石灰水等物质中,属于盐的是(填序号,下同) ,属于酸性氧化物的是 ,能导电的是 ,属于电解质的是 。
(2)有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号 。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式 。
③画出甲元素的原子结构示意图 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素是指在人体内总量不到万分之一,质量总和不到人体质量的千分之一的二十多种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素不是微量元素的是
A.I
B.F
C.H
D.Mn
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com