
【题目】下图是传统的工业生产金属铝的基本流程图,结合铝生产的流程图解答下列各题:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是(填化学式)。石油炼制和煤的干馏产品(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:(用化学方程式表示)。
(4)工业上制取金属镁时是电解熔融MgCl2 , 电解反应方程式为 , 镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物。
【答案】
(1)Al2O3;碳素材料
(2)加入冰晶石(Na3AlF6)和少量CaF2
(3)C+O2 ![]() CO2
CO2
(4)MgCl2(熔融) ![]() Mg+Cl2↑;因为MgO熔点太高,MgCl2熔点低,电解MgCl2耗能少。AlCl3是共价化合物,熔化时不能发生电离
Mg+Cl2↑;因为MgO熔点太高,MgCl2熔点低,电解MgCl2耗能少。AlCl3是共价化合物,熔化时不能发生电离
【解析】(1)铝土矿的主要化学成分是Al2O3 , 另外还有SiO2、Fe2O3、TiO2、H2O等,电解前必须进行提纯。石油炼制、煤的干馏的固体物质的成分为碳,具有导电性,可以作为阳极和阴极材料。(2)纯净Al2O3的熔点很高,而其电解必须在熔融状态下进行,若采用纯净的Al2O3进行电解,则加热熔融需要耗费大量的能量,所以工业上采用加入冰晶石(Na3AlF6)和氟化钙(CaF2)助熔。(3)工业冶炼铝的关键操作是电解,电解时阳极发生氧化反应,熔融物中的O2-失电子,生成O2 , 在电解过程中阳极的材料碳逐渐与生成的氧气反应,在高温条件下生成CO2。(4)因为MgCl2为离子化合物,熔融时能发生电离;AlCl3为共价化合物,熔融时不发生电离;再者MgO熔点很高,很难熔化,耗能太大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】固体D是一种红色氧化物. 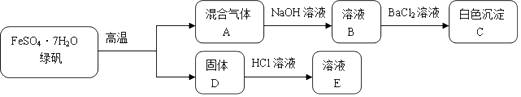
(1)混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有 .
(2)白色沉淀C中加入盐酸的实验现象为 .
(3)固体D与HCl溶液反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表应用的说法不正确的是
A. 在过渡元素中,可以找到半导体材料
B. 第 118 号元素 Og 在周期表中位于第七周期 0 族
C. 在元素周期表中共有 18 列,16 个族
D. 元素周期表为元素性质的系统研究提供指导,为新元素的发现提供线索
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件). 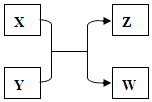
(1)若X的摩尔质量是W的2倍,工业上Z可作优质的耐高温材料.则Y 的化学式 .
(2)若固体W是紫红色,且向溶液Z中滴入氯水,再滴入2滴KSCN溶液, 溶液呈血红色.则写出X+YZ+W 的离子方程式 .
(3)若晶体W是一种重要的半导体材料,实验室可用澄清石灰水来检验Z的 燃烧产物.写出Y与NaOH溶液反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微粒间的作用力主要有离子键、共价键、金属键(存在于金属单质与合金中)、一般的 分子间作用力和氢键,下列各组物质中,所含有的相互作用力类型最多的一组是
A. Na2O2 Na2OB. KClO CO2C. K HBrD. HF NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10﹣13 , 下列说法错误的是( ) 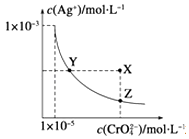
A.t℃时,Ag2CrO4的Ksp为1×10﹣8
B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.一定温度下Y点和Z点时Ag2CrO4的Ksp相等
D.在t℃时,Ag2CrO4(s)+2Br﹣(aq)2AgBr(s)+CrO42﹣(aq)平衡常数K=4.0×1010
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是工业利用铝土矿(含杂质SiO2、Fe2O3)制取铝的工艺流程,回答有关问题: 
(1)铝土矿磨碎化浆,利用胶体粒子的性质,通入直流电除去 , 制得50%铝土矿.
(2)操作I的名称是 , 实验室进行此操作所需玻璃仪器为 .
(3)加入NaOH所发生的离子反应方程式为 , 滤渣一为(填化学式).
(4)电解槽用石墨作阳极,生成二氧化碳的原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com