
| 120 |
| 2×98 |
| 10吨×72% |
| m吨×98% |
| 4mol |
| 4mol+4.8(7-3x)mol+0.2(7-3x)mol |
| 4 |
| 39-15x |
| 4 |
| 39-15x |
| 2.4g |
| 32g/mol |
| 0.15mol×3+0.275mol×2 |
| 2 |
| 0.425mol |
| 0.5mol |


科目:高中化学 来源: 题型:
(2013?浦东新区三模)一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g)?2N2O5(g);已知该反应的平衡常数:k300℃>k350℃,且体系中n(NO2)(单位:mol)随时间变化如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
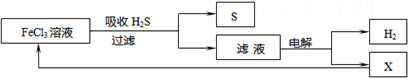
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com