
| A. | Mg2+、K+、NO3-、OH- | B. | Ba2+、NH4+、NO3-、OH- | ||
| C. | Ca2+、K+、SO42-、Cl- | D. | Ba2+、Na+、Cl-、NO3- |
科目:高中化学 来源: 题型:选择题
| A. | 加入FeCl3溶液显紫色,说明存在酚羟基 | |
| B. | 加入金属钠能放出氢气,说明存在羧基 | |
| C. | 能使酸性高锰酸钾溶液褪色,说明存在碳碳双键 | |
| D. | 在2mL 2%的CuSO4溶液中加入10%的NaOH溶液4~5滴配制成氢氧化铜悬浊液,用以检验醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
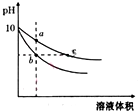 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | 稀释之前,两溶液导电能力相同 | |
| C. | a、b、c三点溶液中水的电离程度c>a>b | |
| D. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vc>Vb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对盛在烧杯(敞口)内的氨水加热,氨水中NH${\;}_{4}^{+}$浓度减小 | |
| B. | 对石灰的悬浊液加热使温度升高,悬浊液中Ca(OH)2固体的含量增加 | |
| C. | 高压有利于合成氨的反应 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯水应保存在棕色瓶中,久置的氯水,pH值减小 | |
| B. | 新制饱和氯水中存在4个平衡 | |
| C. | 在一定浓度的氯水中加小苏打,$\frac{c(HClO)}{c(C{l}^{-})}$变小 | |
| D. | 饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 氰酸铵(NH4OCN)与尿素[CO(NH2)2]都是共价化合物 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)=$\frac{1000b+c(H+)V}{V}$ mol/L | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol/L | |
| C. | 溶质的质量分数w=$\frac{a}{ρV-a}$×100% | |
| D. | 向上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5w |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=-2 878 kJ•mol-1 | B. | △H=-2 658 kJ•mol-1 | ||
| C. | △H=-1 746 kJ•mol-1 | D. | △H=-1 526 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com