
 .
.分析 (1)NaOH是离子化合物,钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键;
(2)工业上用焦炭还原二氧化硅制取粗硅,同时生成CO;
(3)碳酸氢钠和氯化钡反应生成碳酸钡沉淀、二氧化碳和水;
(4)该反应中Mn元素化合价由+2价变为+7价、I元素化合价由+7价变为+5价,高锰酸根离子存在于酸性溶液中,所以还生成H+,根据元素守恒知,反应物还有H2O,根据转移电子相等、原子守恒、电荷守恒配平方程式.
解答 解:(1)NaOH是离子化合物,钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,其电子式为 ,故答案为:
,故答案为: ;
;
(2)工业上用焦炭还原二氧化硅制取粗硅,同时生成CO,反应方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)碳酸氢钠和氯化钡反应生成碳酸钡沉淀、二氧化碳和水,离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O,
故答案为:Ba2++2HCO3-=BaCO3↓+CO2↑+H2O;
(4)该反应中Mn元素化合价由+2价变为+7价、I元素化合价由+7价变为+5价,高锰酸根离子存在于酸性溶液中,所以还生成H+,根据元素守恒知,反应物还有H2O,转移电子数为10,根据转移电子相等、原子守恒、电荷守恒配平方程式为2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,
故答案为:2;5;3H2O;2;5;6H+.
点评 本题考查离子方程式、化学方程式的书写及氧化还原反应配平,为高频考点,明确反应物、生成物及反应条件、物质性质、转移电子守恒是解本题关键,难点是判断(4)中未知反应物和生成物.


科目:高中化学 来源: 题型:选择题
| A. | 1:10:100:1000 | B. | 1011:1010:10:1 | C. | 1:10:1010:1011 | D. | 14:13:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 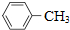 的一溴代物和 的一溴代物和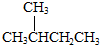 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物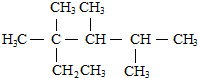 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | 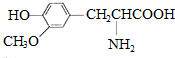 与 与 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、W的简单阴离子具有相同的电子层结构 | |
| B. | 由Y、Z两种元素组成的化合物是离子化合物 | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 原子半径:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
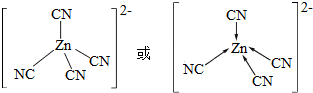 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
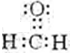 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯与14g苯含有的氢原子数均为2NA | |
| B. | 0.1molFe3+与足量的HI溶液反应,转移的电子数为0.1NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与H2S数目之和为0.1NA | |
| D. | 6.4g铜溶于30mL10mol•L-1硝酸中,产生气体的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
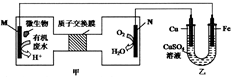 下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )| A. | 甲中H+透过质子交换膜由左向右移动 | |
| B. | M极电极反应式:H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16e- | |
| C. | 一段时间后,乙中CuSO4溶液浓度基本保持不变 | |
| D. | 当N极消耗0.25molO2时,则铁极增重16g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com