
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.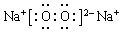 .
. 分析 由图可知,A为H,B为He,C为Na,D为C,E为N,F为O,G为Si,H为Cl,
(1)电子层越多,原子半径越大,同周期从左向右原子半径减小;非金属性越强,最高氧化物对应水化物的酸性越强;
(2)A与E可形成一种极易溶于水的气态化合物为氨气,水分子间含氢键,沸点高;
(3)X原子获得一个电子所释放出的能量是所有短周期元素中最大的,则X的非金属性最强;
(4)化合物来吸收航天员呼出的CO2并放出O2,该物质为过氧化钠.
解答 解:由元素在短周期中的位置可知,A为H,B为He,C为Na,D为C,E为N,F为O,G为Si,H为Cl,
(1)C、D、G三种元素的原子半径由大到小的顺序是Na>Si>C;H、G的最高氧化物对应水化物的酸性由强至弱的顺序是HClO4>H2SiO3(或H4SiO4),
故答案为:Na>Si>C;HClO4>H2SiO3(或H4SiO4);
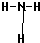
(2)A与E可形成一种极易溶于水的气态化合物为氨气,氨气分子的结构式为 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键,故答案为:
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键,故答案为: ;H2O分子间存在氢键;
;H2O分子间存在氢键;
(3)X元素为F,在周期表中的位置是第2周期第VIIA族,故答案为:第2周期第VIIA族;
(4)化合物来吸收航天员呼出的CO2并放出O2,该物质为过氧化钠,其电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 0.80 | 23.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④ | C. | ①③④⑦ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2W-+Z2═2Z-+W2 | B. | 2X-+Z2═2Z-+X2 | C. | 2Y-+W2═2W-+Y2 | D. | 2Z-+X2═2X-+Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
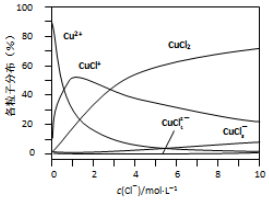
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com