
将适量的铁粉加入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+的物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比
A.3:2 B.1:2 C.2:1 D.2:3
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
(2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
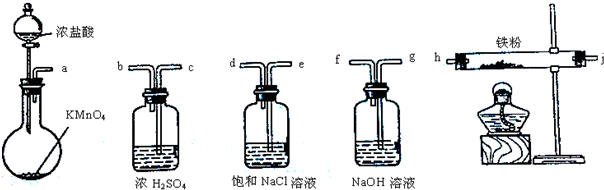
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中含有FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 |
若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中,滴加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com