
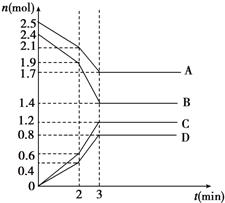
 在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题:
在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题:| △c |
| △t |
| 0.4mol |
| 2L?2min |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学性质相似的有机物一定是同系物 |
| B、分子组成相差一个或几个CH2原子团的有机物一定是同系物 |
| C、若烃中碳、氢元素的质量分数相同,它们必定是同系物 |
| D、互为同分异构体的两种有机物一定不能互称为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com