
| A、4n mol | ||
| B、10n mol | ||
C、
| ||
D、
|
| 10 |
| 3 |


科目:高中化学 来源: 题型:
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
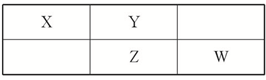 四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.| R | Q | ||
| M | T |
| +x |
| +x |
| 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 的系统命名
的系统命名查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液中滴加少量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO |
| C、向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| D、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L浓度为0.1mol/L AlCl3溶液中含有的离子数是0.4NA |
| B、3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA |
| C、标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA |
| D、标准状况下,1.12L的SO3所含的原子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH-Na2CO3-BaCl2 |
| B、NaOH-BaCl2-Na2CO3 |
| C、BaCl2-NaOH-Na2CO3 |
| D、Na2CO3-BaCl2-NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3用水做成喷泉实验,说明NH3易溶于水 |
| B、用标况下的NH3做成喷泉实验的烧瓶中的溶液的物质的量的浓度可以求出 |
| C、实验时,NH3越纯,效果越好 |
| D、若实验不成功,说明NH3不易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com