
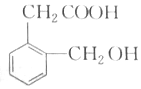
 ),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.
),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.分析 B不与FeCl3溶液发生显色反应,则苯环上没有-OH,1mol该同分异构体能与2molNaOH发生反应,说明分子中含有酯基而且水解后有酚羟基;结合分子中的O原子数目可知,该分子中含有一个酯基和一个醇羟基或醚键;据此分析.
解答 解:B不与FeCl3溶液发生显色反应,则苯环上没有-OH,1mol该同分异构体能与2molNaOH发生反应,说明分子中含有酯基而且水解后有酚羟基;结合分子中的O原子数目可知,该分子中含有一个酯基和一个醇羟基或醚键;
若分子中苯环上含有2个支链,则结构简式为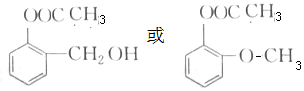 ;
;
若分子中苯环上含有3个支链,而且不具有1、2、3-三取代苯结构,则结构简式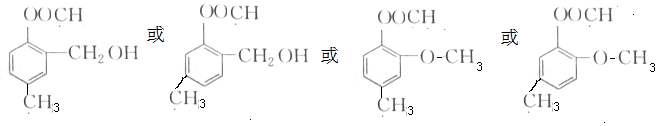 ;满足要求的同分异构种类一共6种;
;满足要求的同分异构种类一共6种;
故答案为:6.
点评 本题主要考查的是同分异构体的判断、有机物的结构与性质,为高频考点,把握官能团与性质的关系以及同分异构体的书写方法是解答的关键,题目难度中等,侧重于考查学生的分析能力和应用能力.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时a+b的值是大于14 | |
| B. | 反应后溶液呈中性 | |
| C. | 反应后溶液中由水电离的c(H+)小于10-7mol/L | |
| D. | 反应前醋酸和NaOH对水的电离影响程度一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
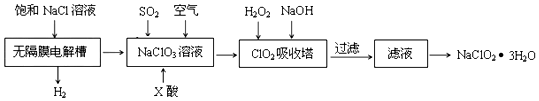
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3可以用作制冷剂 | |
| B. | 硝酸可用于制造炸药的工业原料 | |
| C. | 碳酸钠俗称纯碱,碳酸氢钠俗称苏打 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故不宜采用此法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再变化 | |
| B. | Fe3O4的物质的量不变 | |
| C. | v(H2O)=v(H2) | |
| D. | 断裂4molH-O键的同时,断裂4molH-H键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com