
分析 依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;依据离子积计算离子浓度.
解答 解:(1)某温度下纯水中的c(H+)=2×10-7mol/L,则此时溶液中的c(OH-)=2×10-7mol/L;由于2×10-7mol/L>1×10-7mol/L,故此时pH<7;故答案为:2×10-7mol/L;<;
(2)若温度不变,滴入稀硫酸,使c(H+)=5×10-6mol/L,溶液中则溶液中c(H+)×c(OH-)=4×10-14;c(OH-)=8×10-9mol/L,此时溶液中由水电离产生的c(H+)=8×10-9mol/L;故答案为:8×10-9mol/L;8×10-9mol/L.
点评 本题主要考查了水的离子积应用,溶液中离子积的计算判断,题目较简单.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 元素非金属性:Y>Z | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子半径:X+<Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5×10-7 mol/L | B. | 1×10-7 mol/L | C. | 2×10-7 mol/L | D. | 4×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 0.1mol/LCH3COOH溶液中,氢离子浓度约为0.001mol/L | |
| C. | 醋酸溶液用水稀释后,氢离子浓度下降 | |
| D. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
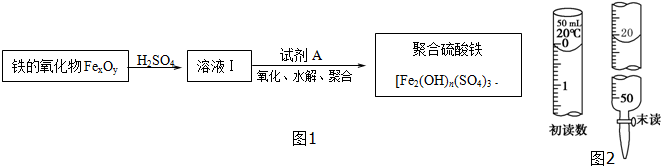
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量溶液Ⅰ于试管A、B中 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com