
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是
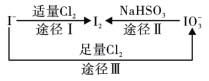
A. 氧化性的强弱顺序为:Cl2 >IO3- >I2
B. 一定条件下, I-与IO3-反应可能生成I2
C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
【答案】C
【解析】
A.由途径I可以知道氧化性Cl2>I2,由途径Ⅱ可以知道氧化性I2< IO3-,由途径Ⅲ可以知道氧化性Cl2>IO3-,故氧化性的强弱顺序为Cl2 >IO3- >I2,故A正确;
B.根据氧化性IO3->I2,所以一定条件下,I-与IO3-反应可能生成I2,故B正确;
C.途径Ⅱ根据转化关系5HSO3-![]() IO3-
IO3- ![]() I2
I2![]() 10e-可以知道,生成1molI2反应中转移的电子数为10NA,消耗5molNaHSO3,所以C选项是错误的;
10e-可以知道,生成1molI2反应中转移的电子数为10NA,消耗5molNaHSO3,所以C选项是错误的;
D.由氧化性的强弱顺序为Cl2 >IO3- >I2可知,向含I-的溶液中通入Cl2,在一定条件下可能把I-氧化成生IO3-,所以得到溶液中加入淀粉溶液不一定变为蓝色,故D正确;
综上所述,本题答案为C。


科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是( )
提示:离子沉淀(或沉淀溶解)pH见下表

A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ/mol P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ/mol P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ/mol,PCl3中P-Cl键的键能为1.2c kJ/mol。 下列叙述正确的是 ( )
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+ PCl3(g)=4PCl5(s)的反应热△H
C. Cl-Cl键的键能为![]() kJ/mol
kJ/mol
D. P-P键的键能为![]() kJ/mol
kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳酸钠、碳酸氢钠的说法正确的是( )

A.25℃时,碳酸氢钠在水中的溶解度比碳酸钠大
B.可用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
C.可用如图所示装置比较Na2CO3和 NaHCO3的热稳定性
D.常温下,浓度均为0.1mol·L-1时,碱性:NaHCO3> Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验方案或说法正确的是
A.  实验室制取乙酸乙酯
实验室制取乙酸乙酯
B.  比较NaHCO3和Na2CO3的热稳定性
比较NaHCO3和Na2CO3的热稳定性
C.  脱脂棉燃烧证明过氧化钠与水反应放热
脱脂棉燃烧证明过氧化钠与水反应放热
D.  a处有红色物质生成,b处变蓝,证明X一定是H2
a处有红色物质生成,b处变蓝,证明X一定是H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32-、SiO32-、AlO2-、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。

(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是________________________,ab段发生反应的离子是________,bc段发生反应的离子方程式为___________________________________。
(2)若Y是NaOH溶液,则X中一定含有的阳离子是____________________, ab段反应的离子方程式为_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种应用较广的催化剂,有关物质的转化关系如下图所示(除B、E外,均为对应物质的溶液参加反应,部分生成物和反应条件已略去)。其中B为气体,能使品红溶液褪色;C为正盐,D为重要的调味剂,E为一种红色的金属氧化物,M的摩尔质量为34gmol-1,它的水溶液常作医用消毒液。

(1)E的化学式________________________。
(2)N的电子式为________________________。
(3)写出反应①的化学方程式:_________________________________________。
(4)写出反应②的离子方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①从石油中获得是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

回答下列问题:
(1)写出A的结构简式:___。
(2)B、D分子中的官能团名称分别是___、___。
(3)写出下列反应的反应类型:①___,②___,④___。
(4)写出下列反应的化学方程式:
①___。
②___。
④___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com