

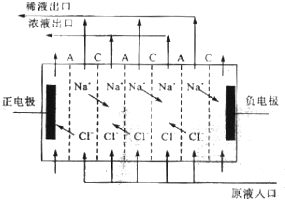
分析 (1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠;
(2)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(3)电渗析法是物理变化,电解是化学变化;
(4)步骤③加铁粉是与碘化银反应生成碘化亚铁;
(5)步骤④是过量的氯气氧化碘离子以及亚铁离子;
(6)硫酸钠与石灰石、焦炭发生反应生成碳酸钠,C作还原剂,其氧化产物可以是CO或CO2,还原产物是CaS,据此写出反应方程式.
解答 解:(1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠,即H2、NaOH,故答案为:H2、NaOH;
(2)步骤①中已获得Br2,步骤②中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,故答案为:SO2+Br2+2H2O=SO42-+2Br-+4H+;提高溴的富集程度;
(3)电渗析法是利用电场的作用,强行将离子向电机处吸引,致使电极中间部位的离子浓度大为下降,说明电渗析法是物理变化,而电解会引起氧化还原反应,是化学变化,故答案为:电渗析法是物理变化,电解是化学变化;
(4)步骤③加铁粉是与碘化银反应生成碘化亚铁,回收银,并有利于提取碘,故答案为:铁粉与碘化银反应生成碘化亚铁,有利于提取碘;
(5)步骤④中能入氯气,氯气先氧化碘离子,再氧化亚铁离子,离子方程式为:2Cl2+2Fe2++2I-=4Cl-+2Fe3++I2,故答案为:2Cl2+2Fe2++2I-=4Cl-+2Fe3++I2;
(6)硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,C作还原剂,它的氧化产物可以是CO或CO2,故反应方程式为:Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2,
故答案为:Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2.
点评 本题考查海水资源的综合利用,涉及到电解、海水提溴工艺等知识点,注意氧化还原反应离子方程式的书写,掌握从海水中提取溴的原理为解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液 | B. | 硫酸氢钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛溶液的体积 | |
| B. | 在过氧化钠固体中,阴离子与阳离子的个数 | |
| C. | 将质量分数为a%的H2SO4溶液蒸发水后变为2a%,蒸发前后H2SO4溶液的物质的量浓度 | |
| D. | 在碳与浓硫酸(加热)的反应中,被还原的H2SO4与参加反应的H2SO4的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯是纯净物,氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强 | |
| D. | 不能用pH试纸测定氯水的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:Y的离子>Z的离子>M的离子>X的离子 | |
| C. | YX2、M2Y都含有极性键 | |
| D. | Z元素的最高价氧化物的水化物的化学式为H2ZO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com