
【题目】 将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是( )
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系。下列有关物质的推断不正确的是
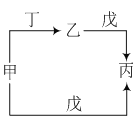
A.若甲为Na,则戊可能是H2O
B.若甲为C2H4,则戊可能是O2
C.若甲为NO,则戊可能是H2O
D.若甲为Cl2,则戊可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属稼是一种广泛用于电子工业和通讯领域的重要金属,稼元素(31Ga)在元素周期表中位于第四周期,IIIA族,化学性质与铝元素相似。
(1)稼元素的原子结构示意图是_______________________。
(2)工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时又有氢气生成。反应中,每生成3molH2时就会放出30.8kJ的热量。
①反应的热化学方程式是________________________;
②反应的化学平衡常数表达式是___________________,温度升高时,反应的平衡常数_____________(填“变大”“变小”或“不变”);[
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是__________
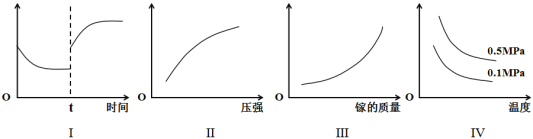
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.IV图像中纵坐标可以为体系内混合气体平均相对分子质量
(3)工业上提纯镓的方法很多,其中以电解精炼法为多。具体原理如下:以待提纯的粗稼(内含Zn、Fe、Cu杂质)为阳极,以高纯稼为阴极,以NaOH水溶液为电解质溶液。 在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是________________;
② GaO2-在阴极放电的电极方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
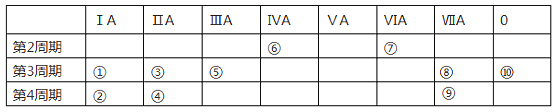
(1)10种元素中,化学性质最不活泼的是________________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是____________。
(4)元素⑦的氢化物常温下和元素⑧的单质反应的化学方程式为:____________。
(5)①和⑨两种元素形成化合物的化学式为_________,该化合物溶液与元素⑧的单质反应的化学方程式为_______________。
(6)已知元素的电负性与元素的化合价一样,也是J已索的一种基本性质。下面给出14种元素的电负性。
元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2 | 1.5 | 2.5 | 2.8 | 4 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,推测元素的电负性的变化规律是:_________,_________。
(2)预测Br与I元素电负性的大小关系_________,前四周期中,电负性最小的元素是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)
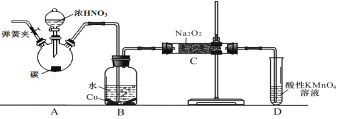
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)A中反应的化学方程式是 。
(2)B中观察的主要现象是 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的操作是 。
(4)经检验C产物中亚硝酸钠含量较少。
a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。
生成碳酸钠的化学方程式是 。为排除干扰甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称)。
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 。
(5)实验经改进后可制得较纯亚硝酸钠,下列说法正确的是 。
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸溶液pH>1
c.已知亚硝酸电离平衡常数为Ka;亚硝酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw
d.0.1mol/L亚硝酸钠溶液中存在:c(NO2-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com