
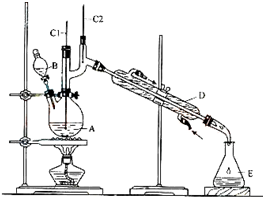
 ����ȩ��һ�ֻ���ԭ�ϣ�ijʵ��С����������װ�úϳ�����ȩ�������ķ�Ӧ���£�
����ȩ��һ�ֻ���ԭ�ϣ�ijʵ��С����������װ�úϳ�����ȩ�������ķ�Ӧ���£�| Na2Cr2O7 |
| ��H2SO4 |
| �е�/�� | �ܶ�/g?cm-3 | ˮ���ܽ��� | |
| ������ | 117.2 | 0.8109 | �� |
| ����ȩ | 75.7 | 0.8017 | �� |
| 74��2 |
| 72��4 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ƽ�ⳣ���ı���ʽ�У���Ӧ������ʼŨ�ȣ���������ƽ��Ũ�� |
| B�����κ������£�һ����ѧ��Ӧ��ƽ�ⳣ��������ı� |
| C��ƽ�ⳣ���Ĵ�С�����¶��йأ���Ũ�ȡ�ѹǿ���������� |
| D��ƽ�ⳣ��Խ��ѧ��Ӧ����Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ���������c��H+��=10-12 mol?Lһ1����Һ�У�K+��Na+��Fe2+��NO3- | ||
| B�������£�pH=7����Һ�У�Al3+��Cl-��HCO3-��SO42- | ||
C�������£�
| ||
| D��pH=13����Һ�У�K+��Ba2+��Cl-��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ��Ŀ�� | ʵ�鷽�� | |
| A | ֤�������鷢����ȥ��Ӧ����ϩ���� | ���Թ��м����������������NaOH���Ҵ���Һ�����ȣ�����Ӧ����������ͨ��������Ȼ�̼��Һ |
| B | ֤��Mg��OH��2��������ת��ΪFe��OH��3���� | ��2mL 1mol/L NaOH��Һ���ȼ���3��1mol/L MgCl2��Һ���ټ���3��1mol/L FeCl3��Һ |
| C | �������ǵ�ˮ�������л�ԭ�� | ��������Һ�м��뼸��ϡ���ᣬˮԡ���ȼ����ӣ������м������Ƶ�������Һ����ˮԡ���� |
| D | ȡ��ֻ�Թܣ��ֱ����4mL 0.01mol/L KMnO4������Һ��Ȼ����һֻ�Թ��м���0.1mol/L H2C2O4��Һ2mL������һֻ�Թ��м���0.2mol/L H2C2O4��Һ4mL����¼��ɫʱ�� | ֤������Ũ��Խ��Ӧ����Խ�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
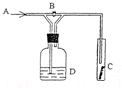 ��ͼ��һ������ij���廯ѧ���ʵ�ʵ��װ�ã�ͼ��BΪ���أ� ���ȴ�B����A��ͨ�����������C�к�ɫ������ɫ�ޱ仯�����ر�Bʱ��C����ɫ������ɫ��ȥ����Dƿ��ʢ�е���Һ�ǣ�������
��ͼ��һ������ij���廯ѧ���ʵ�ʵ��װ�ã�ͼ��BΪ���أ� ���ȴ�B����A��ͨ�����������C�к�ɫ������ɫ�ޱ仯�����ر�Bʱ��C����ɫ������ɫ��ȥ����Dƿ��ʢ�е���Һ�ǣ�������| A��ŨH2SO4 |
| B������Na2CO3��Һ |
| C��ŨNaOH��Һ |
| D������NaCl��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢۢ� | B���ڢܢ� |
| C���ۢܢ� | D���ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
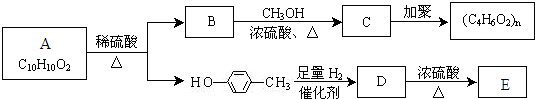
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
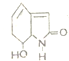
| A������ʽΪC8H10NO2 |
| B����Br2 1��1�ӳ����ɵ�2�ֲ��� |
| C��1mol���л����������3mol H2�����ӳɷ�Ӧ |
| D������ͬ���칹���м����ڷ����廯���������ڦ�-�������ֻ��1�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| A���٢� | B���ڢ� | C���ۢ� | D���٢� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com