
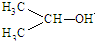 可简写为
可简写为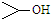 .达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(
.达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(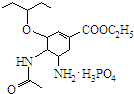 ),有关它的说法错误的是( )
),有关它的说法错误的是( )| A. | 达菲是一种磷酸盐 | |
| B. | 达菲分子中含有肽键 | |
| C. | 达菲的分子式为C16H31N2O8P | |
| D. | 1mol达菲可与2mol H2发生加成反应 |
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
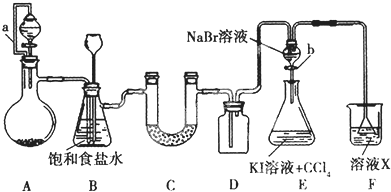
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定不存在Ba2+和HCO3- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定存在SO42-和Cl- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中各原子最外层都满足8电子稳定结构 | |
| B. | 键角均为60°,都是含有极性键的极性分子 | |
| C. | BF3沸点低于BCl3沸点,因为B-F键键长短 | |
| D. | BF3分子稳定性高于BCl3,因为B-F键键能高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述测定不能达到实验目的 | B. | 剩余的7.48g金属为铜 | ||
| C. | 共生成NO气体 0.04mol | D. | 该合金中铜的质量分数为69.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 18g D2O含有的电子数为10NA | |
| C. | 在标准状况下,22.4LSO3的物质的量为1mol | |
| D. | 同温、同压下,相同体积的氟气和氩气所含的原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
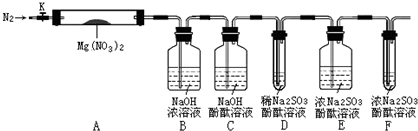
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com