
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:

(1)甲烷燃料电池的负极反应式______.
(2)石墨电极(C)的电极反应式为______.
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为______;丙装置中阴极析出铜的质量为______.
【答案】 CH4-8e-+10OH-=CO32-+7H2O 2Cl--2e-=Cl2↑ 减小 有4.48L 12.8g
【解析】燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O;正确答案:CH4-8e-+10OH-=CO32-+7H2O。
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,正确答案:2Cl--2e-═Cl2↑。
(3)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失电子进入溶液,阴极上析出铜离子,阳极电极方程式分别为Zn-2e-=Zn2+、Cu-2e-=Cu2+,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小,正确答案:减小。
(4)根据串联电池中转移电子数相等得出氧气、氢气和铜的关系式为:O2---2H2---2Cu,氧气有2.24 L(即0.1mol),生成氢气0.2 mol,气体的体积为4.48L ,生成铜0.2×64=12.8g,正确答案:4.48L;12.8 g。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。

(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是_______,负极发生的电极反应方程式为:_____________________。若反应消耗16.25 g 负极材料,则电池中转移电子的物质的量为______mol。
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A. ①③ B. ②④ C. ①④ D. ②③
(3)右图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的______(填“正”或“负”)极,Y极的电极反应方程式为____________________。
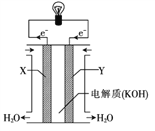
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
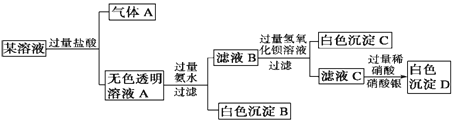
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。

根据上述实验,以下推测不正确的是
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
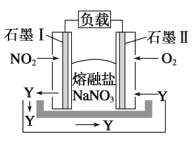
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室模拟以工业用菱铁矿(FeCO3)含碱式碳酸铜[Cu2(OH)2CO3]为原料制取纯净的FeCO3和氯化铜晶体(CuCl2·2H2O)的生产流程如下:
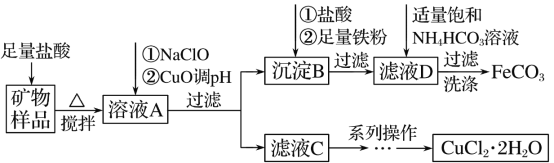
(1)盐酸溶解矿物样品时可能发生的离子方程式______。
(2)写出向溶液A中加入NaClO的离子方程式_________。
(3)向沉淀B中依次加入盐酸和铁粉时可能发生的离子方程式_________。
(4)处理滤液D时,除产生沉淀外,还产生无色气体,写出该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”或“抑制”)其水解.
(2)明矾可用于净水,原因是(用离子方程式表示):____________________
(3)泡沫灭火器灭火原理(用离子方程式表示)_____________________
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
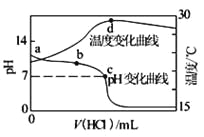
A. 氨水的电离程度a>b>c
B. a、d两点的溶液,水的离子积Kw(a)>Kw(d)
C. c点时消耗盐酸体积V(HCl)<20.00ml
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下:
____ FeS2+ ____ H++ ____ NO3-= ____ Fe2++ ____ S↓+ ____ NO↑+ ____H2O
回答下列问题:配平此氧化还原反应方程式_____________________________________,还原剂为______________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是_____(填字母)
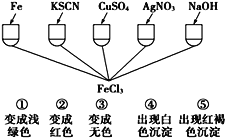
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com