


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| A、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| B、根据水溶液是否导电,将物质分为电解质和非电解质 |
| C、根据是否含氧元素,将物质分为氧化剂和还原剂 |
| D、根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
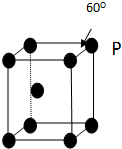 A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.
A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.查看答案和解析>>
科目:高中化学 来源: 题型:
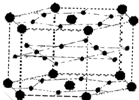 A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧元素的相对原子质量 |
| B、氧元素的一种同位素的近似相对原子质量 |
| C、氧元素的近似相对原子质量 |
| D、氧元素的一种同位素的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
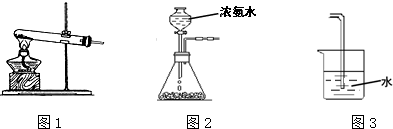
| 催化剂 |
| 高温高压 |
| N≡N | H-H | N-H | |
| 键能/kJ?mol-1 | 945 | 436 | 391 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com