
| 实验编号 | 实验步骤 | 实验现象 |
| ① | 加入AgNO3溶液 | 有沉淀产生 |
| ② | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ③ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
 =0.04mol
=0.04mol =0.04mol;
=0.04mol;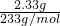 =0.01mol;BaCO3的质量为m(BaCO3)=6.27g-2.33g=3.94g,n(CO32-)=n(BaCO3)=
=0.01mol;BaCO3的质量为m(BaCO3)=6.27g-2.33g=3.94g,n(CO32-)=n(BaCO3)=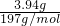 =0.02mol;
=0.02mol;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(2012?顺义区二模)某混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现每次取100mL溶液分别进行下列实验:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com