
| A. | HClO的电子式为 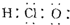 | |
| B. | H2S的电子式可表示为 | |
| C. | 用电子式表示Na2O的形成过程为2Na×+ →2Na+ →2Na+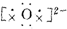 | |
| D. | MgCl2的电子式为 Mg2+ Mg2+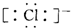 |
分析 A.HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;B.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键;C.Na2O为离子化合物,根据离子化合物的电子式表示方法写出Na2O的形成过程;D.氯化镁为离子化合物,必须标出阴阳离子的电子式.
解答 解:A.HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: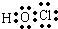 ,故A错误;B.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为:
,故A错误;B.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: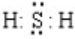 ,故B错误;C.Na2O为离子化合物,用电子式表示Na2O的形成过程为:
,故B错误;C.Na2O为离子化合物,用电子式表示Na2O的形成过程为: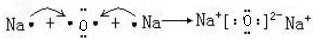 ,故C错误;D.氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为:
,故C错误;D.氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: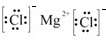 ,故D正确,故选D.
,故D正确,故选D.
点评 本题考查学生对化学中化学用语的掌握程度,熟悉物质的结构及电子式书写方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:填空题
 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极.若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示,请回答下列问题
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极.若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0句 | B. | 1句 | C. | 2句 | D. | 3句 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 300mL3.5 mol/L KCl溶液 | B. | 1000mL2.5mol/L NaCl溶液 | ||
| C. | 250mL1 mol/L AlCl3溶液 | D. | 200mL2mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时16O的相对原子质量为32 | |
| B. | 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L | |
| C. | 标况下44gCO2的体积为22.4L | |
| D. | NA个氧分子与NA个氢分子有相同数目的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
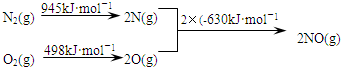
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com