
| A. | 1.6gCH4中含有的分子数 | |
| B. | 1molH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下22.4LCO气体中含有的分子数 |
分析 A.依据n=$\frac{m}{M}$质量转化为物质的量;
B.1molH2SO4中含有2mol的氢离子;
C.依据n=$\frac{m}{M}$质量转化为物质的量;
D.依据n=$\frac{V}{{V}_{m}}$计算.
解答 解:A.1.6 g CH4物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,含有6.02×1022个分子,故A错误;
B.根1molH2SO4中含有2mol的氢离子,氢离子数目为1.204×1024,故B错误;
C.2.4gMg物质的量为$\frac{2.4g}{24g/mol}$=0.1mol,含有的原子数,6.02×1022个,故C错误;
D.标准状况下,22.4LCO气体物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,含有的分子数6.02×1023,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,明确好以物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,题目较简单.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:填空题
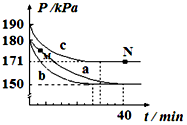 臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)?N2O5(g)+O2(g).若在容积为10L的密闭容器中进行该反应,起始时充入0.4molNO2、0.2molO3,反应分别在a、b、c三种不同条件下进行,反应体系总压强随时间的变化如图所示.
臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)?N2O5(g)+O2(g).若在容积为10L的密闭容器中进行该反应,起始时充入0.4molNO2、0.2molO3,反应分别在a、b、c三种不同条件下进行,反应体系总压强随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应类型 | 反应条件 |
| A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
| B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
| C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
| D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe2+、Cl-、NO3- | B. | CO32-、SO42-、Na+、K+ | ||
| C. | Cl-、MnO4-、OH-、K+ | D. | Mg2+、SO42-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l mol任何气体的体积都约是22.4L | |
| B. | l mol任何物质在标准状况下所占体积都约是22.4L | |
| C. | 不同的气体,体积相同,它们所含的分子数可能不同 | |
| D. | 在同温同压下,相同质量的氯气和氢气体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤液中一定有Fe2(SO4)3和FeSO4 | |
| B. | 滤液中可能有CuSO4,一定有FeSO4、ZnSO4 | |
| C. | 滤渣中一定有Cu和Fe,一定无Zn | |
| D. | 滤渣中可能有Cu、Fe和Zn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com