
| 实验序号 | a | b | c |
| 合金质量(g) | 0.51 | 0.765 | 0.918 |
| 气体体积(mL) | 560 | 672 | 672 |
 (3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
(3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.分析 I.(1)盐酸浓、体积一定,a中合金质量小于b中合金质量,且a中生成气体体积小于b中气体体积,说明a中盐酸过量、金属完全反应,b中合金质量小于c中合金质量,且b、c生成气体体积相等,说明b、c中盐酸完全反应,可以根据反应生成氢气体积计算盐酸的物质的量浓度;
(2)a组中合金完全反应,令镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算解答;
(3)结合(2)中可知0.918g合金中Al的物质的量,使c组中剩余的Al恰好完全溶解,此时溶液中溶质为NaCl、NaAlO2,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),进而计算氢氧化钠溶液的体积.
Ⅱ.(1)中性条件下,发生类似钢铁的吸氧腐蚀;
(2)NaCl没有参与反应,提高溶液导电能力;
(3)电解KI溶液制取KIO3(以石墨为电极材料)时,阳极发生氧化反应,I-在阳极失去电子生成IO3-,应有水参加反应,由电荷守恒应有氢离子生成.
解答 解:I.(1)盐酸浓、体积一定,a中合金质量小于b中合金质量,且a中生成气体体积小于b中气体体积,说明a中盐酸过量、金属完全反应,b中合金质量小于c中合金质量,且b、c生成气体体积相等,说明b、c中盐酸完全反应,盐酸完全反应生成氢气672mL,氢气的物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.03mol=0.06mol,故盐酸的物质的量浓度为$\frac{0.06mol}{0.03L}$=2mol/L,
(2)a组中合金完全反应,令镁、铝的物质的量分别为xmol、ymol,根据二者质量可知24x+27y=0.51,根据电子转移守恒有2x+3y=$\frac{0.56}{22.4}$×2,联立方程解得:x=0.01、y=0.01,故合金中镁的质量分数为$\frac{0.01mol×24g/mol}{0.51g}$×100%=47%,
故答案为:47%;
(3)结合(2)中可知0.918g合金中Al的物质的量为0.01mol×$\frac{0.918g}{0.51g}$=0.018mol,使c组中剩余的Al恰好完全溶解,此时溶液中溶质为NaCl、NaAlO2,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2)=n(HCl)+n(Al)=0.06mol+0.018mol=0.078mol,故需要氢氧化钠溶液的体积为$\frac{0.078mol}{1mol/L}$=0.078L=78mL,
故答案为:78;
Ⅱ.(1)中性条件下,发生金属的吸氧腐蚀,该电池的总反应的化学方程式为4Al+3O2+6H2O=4Al(OH)3,
故答案为:4Al+3O2+6H2O=4Al(OH)3;
(2)NaCl没有参与反应,其作用是:增强溶液导电能力,
故答案为:增强溶液导电能力;
(3)电解KI溶液制取KIO3(以石墨为电极材料)时,阳极发生氧化反应,I-在阳极失去电子生成IO3-,应有水参加反应,由电荷守恒应有氢离子生成,阳极电极反应式为:I-+3H2O-6e-=IO3-+6H+,
故答案为:I-+3H2O-6e-=IO3-+6H+.
点评 本题考查混合物的计算、原电池与电解原理,属于拼合型题目,I中根据表中数据关系判断反应的过量问题是关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
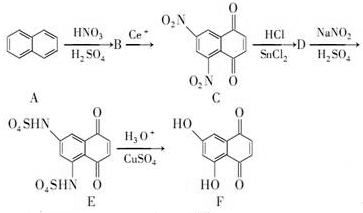
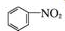 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$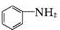 +SnCl4
+SnCl4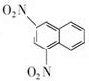 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
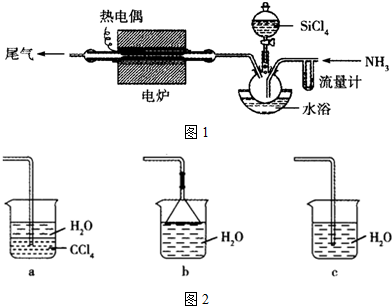
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | y=1×a% | B. | y=1-1×a% | C. | y=1×a%=0.5 | D. | y=1-1×a%<0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
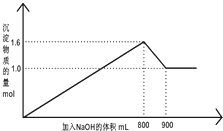 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:| 溶质 | A1Cl3 | FeCl3 |
| 物质的量浓度 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④⑤ | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com