
化学与工农业生产、人类生活密切相关。下列说法中正确的是( )
A.高纯度的二氧化硅晶体广泛用作制造光导纤维和太阳能电池板材料
B.葡萄糖注射液不能产生丁达尔效应,不属于胶体
C.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
D.海水中含有钾、钠元素,只需经过物理变化就可以得到钾和钠单质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列物质能使品红溶液褪色,且褪色原理基本相同的组合是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤
C.②④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是(双选)( )
A.MnS的Ksp比CuS的Ksp小
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=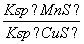
查看答案和解析>>
科目:高中化学 来源: 题型:

某活动小组测定制取的Na2S2O3·5H2O的纯度的方法如下:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O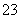 +I2===S4O
+I2===S4O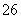 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为______________,为何此种情况能测出NaOH的含量?________________。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?________________________________________________________________________,
请说明理由:__________________________________________________________________。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合

溶液稀释至250 mL,然后用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O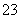 ===2I-+S4O
===2I-+S4O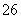 )。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
)。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
| 滴定次数 | 待测液的 体积(mL) | 滴定前的 读数(mL) | 滴定后的 读数(mL) |
| 第一次 | 25.00 | 0.00 | V=________ |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________,下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
化学遍及人们的生活、工作和生产。下列说法不正确的是( )
A.合成氨工业中使用的氮气来自于空气
B.“地沟油”经加工处理后,可用于生产肥皂和生物柴油
C.亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制
D.利用合适的催化剂可以将机动车尾气中的CO和NO转化为无害物质
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离。下列叙述正确的是( )
A.该溶液的pH=3
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的105倍
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是(双选)( )
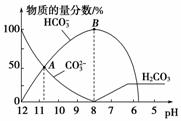
A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=2c(CO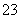 )+c(HCO
)+c(HCO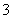 )+c(OH-)
)+c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO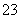 )=c(HCO
)=c(HCO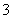 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com