
 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题:
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题:分析 (1)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
(2)由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②玻璃液封装置可防止有害气体逸出;
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
(4)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子.
解答 解:(1)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3还原产物为ClO2 ,还原剂为Na2SO3,被氧化得到氧化产物SO42-,由离子反应可知该反应氧化产物与还原错误物质的量之比为1:2,
故答案为:1:2;
(2)A.ClO2易溶于水,不能利用水吸收氨,故A错误;
B.浓硫酸可以吸收氨气,且不影响ClO2,故B正确;
C.碱石灰不能吸收氨气,故C错误;
D.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故D错误;
故答案为:B;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②玻璃液封装置的作用是吸收残留的ClO2气体避免碘的逸出,
故答案为:吸收残留的ClO2气体;
③含有Na2S2O3物质的量为0.02 L×0.1mol/L=0.002 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,
所以m(ClO2)=0.004 mol×67.5g/mol=0.02700g,
故答案为:0.02700;
(4)若要除去超标的亚氯酸盐,AD均不能还原亚氯酸盐,B中KI具有还原性但氧化产物不适合饮用水使用,只有C中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是C,
故答案为:C.
点评 本题考查物质含量的测定,为高频考点,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:解答题
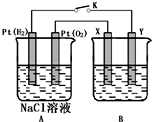 某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
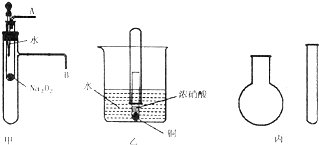 “套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/L NH4HCO3中溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol/L NaHSO3中溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3中溶液中通入SO2:c(Na+)=2[c(H2SO3)+c(HSO3-)+c(SO32-)] | |
| D. | 向0.10mol/L CH3COONa中溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2气体通入Na2SiO3溶液中 | B. | CO2气体通入饱和Na2CO3溶液中 | ||
| C. | SO2气体通入BaCl2溶液中 | D. | SO2气体通入Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2═Ba2++2OH- | B. | AlCl3═Al3++Cl3- | ||
| C. | H2SO4═2H++S6++4O2- | D. | Na2CO3═Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | NH3分子的电子式: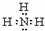 | ||
| C. | 铝原子的结构示意图: | D. | 聚丙烯的结构简式为: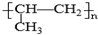 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com