
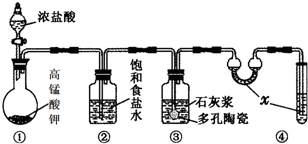
 实验室常用以下几种方法制取氯气
实验室常用以下几种方法制取氯气
| ||
| ||
| ||
 ,氧化产物与还原产物都是氯气,其中
,氧化产物与还原产物都是氯气,其中| 5 |
| 6 |
| 1 |
| 6 |
| 5 |
| 6 |
| 1 |
| 6 |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
| 选项 | 叙述I | 叙述II |
| A | 二氧化硅有导电性 | 二氧化硅可用于制备光导纤维 |
| B | 次氯酸有强氧化性 | 次氯酸可以使有色布条褪色 |
| C | Fe3+具有氧化性 | 可以用KSCN溶液检验的Fe 3+存在 |
| D | Na2O、Na2O2组成元素相同 | 与二氧化碳反应产物也相同 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液和稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| B、浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| C、SO2通入溴水中:SO2+Br2+2H2O=SO42-+2Br-+4H+ |
| D、钠放于水中:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
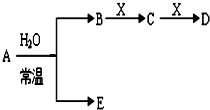 已知如图是常见元素形成的单质或化合物A、B、C、D、E、X转化关系(部分生成物和反应条件略去)
已知如图是常见元素形成的单质或化合物A、B、C、D、E、X转化关系(部分生成物和反应条件略去)查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.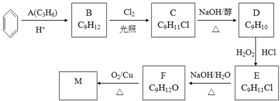
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:查看答案和解析>>
科目:高中化学 来源: 题型:

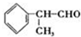
 .化合物
.化合物 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以 和
和 为原料制备该化合物的合成路线流程图(无机试剂任用).
为原料制备该化合物的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:
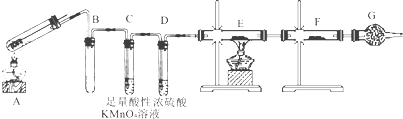
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下
| ||
| B、向碳酸氢钙溶液中加入过量氢氧化钠溶液发生反应的离子方程式可表示为:Ca2++HCO3-+OH-═CaCO3↓+H2O | ||
| C、加入铝能放出H2的溶液中一定能大量存在Cu2+、Na+、NO3-、C1?四种离子 | ||
| D、常温下将0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com