
”¾ĢāÄæ”æ¼īŹ½Ģ¼ĖįĶ[xCuCO3”¤yCu(OH)2]£¬³Źæ×ČøĀĢŃÕÉ«.ÓÖ³ĘĪŖæ×ČøŹÆ£¬ŹĒŅ»ÖÖĆū¹óµÄæóĪļ±¦ŹÆ”£ĖüÓėĶÓėæÕĘųÖŠµÄŃõĘų”¢¶žŃõ»ÆĢ¼ŗĶĖ®ÕōĘųµČĪļÖŹ·“Ó¦²śÉśµÄĪļÖŹ”£CuSO4ČÜŅŗÓėNa2CO3ČÜŅŗ·“Ó¦æÉŅŌµĆµ½¼īŹ½Ģ¼ĖįĶ£¬ĪŅĆĒ½«¶ŌĘä×é³É½ųŠŠĻą¹ŲĢ½¾æ”£
[³ĮµķÖʱø]
³ĘČ”12. 5 gµØ·Æ(CuSO4 5H2O)ČÜÓŚ87. 5mLÕōĮóĖ®ÖŠ£¬µĪ¼ÓÉŁĮæĻ”ĮņĖį(Ģå»żæÉŅŌŗöĀŌ²»¼Ę)£¬³ä·Ö½Į°čŗóµĆµ½CuSO4ČÜŅŗ”£ĻņĘäÖŠ¼ÓČėNa2CO3ČÜŅŗ£¬½«ĖłµĆĄ¶ĀĢÉ«Šü×ĒŅŗ¹żĀĖ£¬²¢ÓĆÕōĮóĖ®Ļ“µÓ£¬ŌŁÓĆĪŽĖ®ŅŅ“¼Ļ“µÓ£¬×īŗóµĶŲŗęøɱøÓĆ”£
[ŹµŃéĢ½¾æ]ĪŅĆĒÉč¼ĘĮĖČēĻĀ×°ÖĆ£¬ÓĆÖʵƵĥ¶ĀĢÉ«¹ĢĢå½ųŠŠŹµŃ锣

øł¾ŻŅŌÉĻŹµŃé»Ų“šĻĀĮŠĪŹĢā
(1)ÅäÖĘĮņĖįĶČÜŅŗµÄ¹ż³ĢÖŠµĪ¼ÓĻ”ĮņĖįµÄ×÷ÓĆŹĒ___________£¬ĖłµĆĮņĖįĶČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżĪŖ_________
(2)ŹµŃéŹŅĶس£Ź¹ÓĆ¼ÓČČŃĒĻõĖįÄĘŗĶĀČ»Æļ§»ģŗĻČÜŅŗµÄ·½·ØÖĘČ”N2£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢĪŖ£ŗ__________”£
¢ĒD×°ÖĆ¼ÓČČĒ°£¬ŠčŅŖŹ×ĻČ“ņæŖ»īČūK£¬ĶØČėŹŹĮæN2£¬Č»ŗó¹Ų±ÕK£¬ŌŁµćČ¼D“¦¾Ę¾«µĘ”£ĶØČėN2µÄ×÷
ÓĆ___________£¬ BĪŖ°²Č«Ę棬Ęä×÷ÓĆŌĄķĪŖ_________£¬CÖŠŹ¢×°µÄŹŌ¼ĮÓ¦ŹĒ__________”£
(4)¼ÓČČDŗó¹Ū²ģµ½µÄĻÖĻóŹĒ________________”£
(5)¾²éŌÄĪÄĻ×ÖŖ£ŗKsp[CaCO3]=2.8”Į10-9£¬Ksp[BaCO3]=5.1”Į10-9£¬¾ĢÖĀŪČĻĪŖŠčŅŖÓĆBa(OH)2ČÜŅŗ“śĢę³ĪĒåŹÆ»ŅĖ®Ą“¶ØĮæ²ā¶ØĄ¶ĀĢÉ«¹ĢĢåµÄ»ÆѧŹ½£¬ĘäŌŅņŹĒ______________
a.Ba(OH)2µÄ¼īŠŌ±ČCa(OH)2Ēæ
b.Ba(OH)2Čܽā¶Č“óÓŚCa(OH)2£¬Äܳä·ÖĪüŹÕCO2
c.ĻąĶ¬Ģõ¼žĻĀ£¬CaCO3µÄČܽā¶ČĆ÷ĻŌ“óÓŚBaCO3
d.ĪüŹÕµČĮæCO2Éś³ÉµÄBaCO3µÄÖŹĮæ“óÓŚCaCO3£¬²āĮæĪó²īŠ”
(6)“żDÖŠ·“Ó¦ĶźČ«ŗ󣬓ņæŖ»īČūK£¬ŌŁ“ĪµĪ¼ÓNaNO2ČÜŅŗ²śÉśN2£¬ĘäÄæµÄŹĒ______________”£Čō×°ÖĆFÖŠŹ¹ÓĆBa(OH)2ČÜŅŗ£¬ŹµŃé½įŹųŗó¾³ĘĮ棬װÖĆEµÄÖŹĮæŌö¼Ó0.27g£¬FÖŠ²śÉś³Įµķ1.97g”£ŌņøĆĄ¶ĀĢÉ«¹ĢĢåµÄ»ÆѧŹ½ĪŖ_____________”£[Š“³ÉxCuCO3”¤yCu(OH)2µÄŠĪŹ½]
”¾“š°ø”æ ŅÖÖĘCu2+Ė®½ā£¬·ĄÖ¹ČÜŅŗ±ä»ė×Ē 8.0% NaNO2+NH4Cl![]() NaCl+N2”ü+2H2O Åųż×°ÖĆÖŠµÄæÕĘų µ±×°ÖĆÄŚŃ¹Į¦¹ż“óŹ±£¬BĘæÖŠ¼äµÄ°²Č«¹ÜÖŠŅŗĆęÉĻÉż£¬Ź¹Ń¹Į¦ĪČ¶Ø ÅØĮņĖį Ó²ÖŹ²£Į§¹ÜÖŠĄ¶ĀĢÉ«¹ĢĢå±äŗŚÉ«£¬EÖŠ°×É«¹ĢĢå±äĄ¶£¬FÖŠČÜŅŗ±ä»ė×Ē bd ČĆĶ£ĮōŌŚ×°ÖĆÖŠµÄĘųĢå±»³ä·ÖĪüŹÕ£¬¼õŠ”ŹµŃéĪó²ī 2CuCO3”¤3Cu(OH)2
NaCl+N2”ü+2H2O Åųż×°ÖĆÖŠµÄæÕĘų µ±×°ÖĆÄŚŃ¹Į¦¹ż“óŹ±£¬BĘæÖŠ¼äµÄ°²Č«¹ÜÖŠŅŗĆęÉĻÉż£¬Ź¹Ń¹Į¦ĪČ¶Ø ÅØĮņĖį Ó²ÖŹ²£Į§¹ÜÖŠĄ¶ĀĢÉ«¹ĢĢå±äŗŚÉ«£¬EÖŠ°×É«¹ĢĢå±äĄ¶£¬FÖŠČÜŅŗ±ä»ė×Ē bd ČĆĶ£ĮōŌŚ×°ÖĆÖŠµÄĘųĢå±»³ä·ÖĪüŹÕ£¬¼õŠ”ŹµŃéĪó²ī 2CuCO3”¤3Cu(OH)2
”¾½āĪö”æ±¾ŹŌĢāæ¼²éŹµŃéÉč¼Ę·½°øµÄĘĄ¼Ū£¬£Ø1£©CuSO4ŹōÓŚĒæĖįČõ¼īŃĪ£¬ČÜŅŗÖŠ“ęŌŚCu2£«£«H2O ![]() Cu(OH)2£«H£«£¬µĪ¼ÓĻ”ĮņĖį£¬H£«ÅضČŌö“ó£¬ŅÖÖĘCu2£«µÄĖ®½ā£¬Ņņ“ĖµĪ¼ÓĻ”ĮņĖįµÄ×÷ÓĆŹĒŅÖÖĘCu2£«Ė®½ā£¬·ĄÖ¹ČÜŅŗ±ä»ė×Ē£»ČÜÖŹµÄÖŹĮæm(CuSO4)=12.5”Į160/250g=8g£¬ČÜŅŗµÄÖŹĮæĪŖ(12.5£«87.5)g=100g£¬ŌņÖŹĮæ·ÖŹżĪŖ8/100”Į100%=8%£»£Ø2£©NaNO2ÓėNH4Cl·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬NaNO2£«NH4Cl”śNaCl£«N2”ü£«H2O£¬NaNO2ÖŠN»ÆŗĻ¼ŪÓÉ£«3¼Ū”ś0¼Ū£¬NH4ClÖŠNµÄ»ÆŗĻ¼ŪÓÉ£3¼Ū”ś0¼Ū£¬øł¾Ż»ÆŗĻ¼ŪµÄÉż½µ·Ø½ųŠŠÅäĘ½£¬Č»ŗóøł¾ŻŌ×ÓŹŲŗćÅäĘ½ĘäĖū£¬¼“·“Ó¦·½³ĢŹ½ĪŖNaNO2+NH4Cl
Cu(OH)2£«H£«£¬µĪ¼ÓĻ”ĮņĖį£¬H£«ÅضČŌö“ó£¬ŅÖÖĘCu2£«µÄĖ®½ā£¬Ņņ“ĖµĪ¼ÓĻ”ĮņĖįµÄ×÷ÓĆŹĒŅÖÖĘCu2£«Ė®½ā£¬·ĄÖ¹ČÜŅŗ±ä»ė×Ē£»ČÜÖŹµÄÖŹĮæm(CuSO4)=12.5”Į160/250g=8g£¬ČÜŅŗµÄÖŹĮæĪŖ(12.5£«87.5)g=100g£¬ŌņÖŹĮæ·ÖŹżĪŖ8/100”Į100%=8%£»£Ø2£©NaNO2ÓėNH4Cl·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬NaNO2£«NH4Cl”śNaCl£«N2”ü£«H2O£¬NaNO2ÖŠN»ÆŗĻ¼ŪÓÉ£«3¼Ū”ś0¼Ū£¬NH4ClÖŠNµÄ»ÆŗĻ¼ŪÓÉ£3¼Ū”ś0¼Ū£¬øł¾Ż»ÆŗĻ¼ŪµÄÉż½µ·Ø½ųŠŠÅäĘ½£¬Č»ŗóøł¾ŻŌ×ÓŹŲŗćÅäĘ½ĘäĖū£¬¼“·“Ó¦·½³ĢŹ½ĪŖNaNO2+NH4Cl![]() NaCl+N2”ü+2H2O£»£Ø3£©¼ÓČČĒ°£¬ĶØČėN2µÄÄæµÄŹĒÅųż×°ÖĆÖŠæÕĘų£»×°ÖĆBĪŖ°²Č«Ę棬Ęä×÷ÓĆŌĄķŹĒµ±×°ÖĆÄŚŃ¹Į¦¹ż“óŹ±£¬BĘæÖŠ¼äµÄ°²Č«¹ÜÖŠŅŗĆęÉĻÉż£¬Ź¹Ń¹Į¦ĪČ¶Ø£»øł¾ŻŹµŃéÄæµÄ£¬ŠčŅŖŃéÖ¤Ą¶ĀĢÉ«¹ĢĢåŹÜČČµÄ²śĪļ£¬Ņņ“ĖN2ÖŠµÄĖ®ÕōĘų¶ŌŗóŠųŹµŃé²śÉśøÉČÅ£¬±ŲŠė³żČ„£¬×°ÖĆCµÄ×÷ÓĆŹĒ³żČ„N2ÖŠµÄĖ®ÕōĘų£¬¼“×°ÖĆCŹ¢·ÅµÄŹŌ¼ĮŹĒÅØĮņĖį£»£Ø4£©²śĪļŹĒCuO”¢H2O”¢CO2£¬Ó²ÖŹ²£Į§¹ÜÖŠĄ¶ĀĢÉ«¹ĢĢå±äŗŚÉ«£¬EÖŠ°×É«¹ĢĢå±äĄ¶£¬FÖŠČÜŅŗ±ä»ė×Ē£»£Ø5£©ÓĆBa(OH)2ČÜŅŗ“śĢęCa(OH)2£¬ŌŅņŹĒ£ŗBa(OH)2µÄČܽā¶Č“óÓŚCa(OH)2Čܽā¶Č£¬Äܳä·ÖĪüŹÕCO2£¬BaµÄĻą¶ŌŌ×ÓÖŹĮæ“óÓŚCaµÄĻą¶ŌŌ×ÓÖŹĮ棬¼“BaCO3µÄĦ¶ūÖŹĮæ“óÓŚCaCO3µÄĦ¶ūÖŹĮ棬¼õÉŁ³ĘĮæŹ±²śÉśµÄĪó²ī£¬¹ŹŃ”ĻībdÕżČ·£»£Ø6£©·“Ó¦½įŹųŗ󣬼ĢŠųĶØČėµŖĘų×÷ÓĆŹĒČĆĶ£ĮōŌŚ×°ÖĆÖŠµÄĘųĢå±»³ä·ÖĪüŹÕ£¬¼õŠ”ŹµŃéĪó²ī£»×°ÖĆEÖŹĮæŌö¼ÓµÄŹĒH2OµÄÖŹĮ棬¼“n(H2O)=0.27/18mol=0.015mol£¬FÖŠ³ĮµķŹĒBaCO3£¬¼“n(CO2)=1.97/197mol=0.01mol£¬HŌŖĖŲĄ“×ŌÓŚCu(OH)2£¬ŌņCu(OH)2µÄĪļÖŹµÄĮæĪŖ0.015mol£¬CĄ“×ŌÓŚCuCO3£¬ŌņCuCO3µÄĪļÖŹµÄĮæĪŖ0.01mol£¬x:y=0.01£ŗ0.015=2£ŗ3£¬¼“2CuCO3”¤3Cu(OH)2”£
NaCl+N2”ü+2H2O£»£Ø3£©¼ÓČČĒ°£¬ĶØČėN2µÄÄæµÄŹĒÅųż×°ÖĆÖŠæÕĘų£»×°ÖĆBĪŖ°²Č«Ę棬Ęä×÷ÓĆŌĄķŹĒµ±×°ÖĆÄŚŃ¹Į¦¹ż“óŹ±£¬BĘæÖŠ¼äµÄ°²Č«¹ÜÖŠŅŗĆęÉĻÉż£¬Ź¹Ń¹Į¦ĪČ¶Ø£»øł¾ŻŹµŃéÄæµÄ£¬ŠčŅŖŃéÖ¤Ą¶ĀĢÉ«¹ĢĢåŹÜČČµÄ²śĪļ£¬Ņņ“ĖN2ÖŠµÄĖ®ÕōĘų¶ŌŗóŠųŹµŃé²śÉśøÉČÅ£¬±ŲŠė³żČ„£¬×°ÖĆCµÄ×÷ÓĆŹĒ³żČ„N2ÖŠµÄĖ®ÕōĘų£¬¼“×°ÖĆCŹ¢·ÅµÄŹŌ¼ĮŹĒÅØĮņĖį£»£Ø4£©²śĪļŹĒCuO”¢H2O”¢CO2£¬Ó²ÖŹ²£Į§¹ÜÖŠĄ¶ĀĢÉ«¹ĢĢå±äŗŚÉ«£¬EÖŠ°×É«¹ĢĢå±äĄ¶£¬FÖŠČÜŅŗ±ä»ė×Ē£»£Ø5£©ÓĆBa(OH)2ČÜŅŗ“śĢęCa(OH)2£¬ŌŅņŹĒ£ŗBa(OH)2µÄČܽā¶Č“óÓŚCa(OH)2Čܽā¶Č£¬Äܳä·ÖĪüŹÕCO2£¬BaµÄĻą¶ŌŌ×ÓÖŹĮæ“óÓŚCaµÄĻą¶ŌŌ×ÓÖŹĮ棬¼“BaCO3µÄĦ¶ūÖŹĮæ“óÓŚCaCO3µÄĦ¶ūÖŹĮ棬¼õÉŁ³ĘĮæŹ±²śÉśµÄĪó²ī£¬¹ŹŃ”ĻībdÕżČ·£»£Ø6£©·“Ó¦½įŹųŗ󣬼ĢŠųĶØČėµŖĘų×÷ÓĆŹĒČĆĶ£ĮōŌŚ×°ÖĆÖŠµÄĘųĢå±»³ä·ÖĪüŹÕ£¬¼õŠ”ŹµŃéĪó²ī£»×°ÖĆEÖŹĮæŌö¼ÓµÄŹĒH2OµÄÖŹĮ棬¼“n(H2O)=0.27/18mol=0.015mol£¬FÖŠ³ĮµķŹĒBaCO3£¬¼“n(CO2)=1.97/197mol=0.01mol£¬HŌŖĖŲĄ“×ŌÓŚCu(OH)2£¬ŌņCu(OH)2µÄĪļÖŹµÄĮæĪŖ0.015mol£¬CĄ“×ŌÓŚCuCO3£¬ŌņCuCO3µÄĪļÖŹµÄĮæĪŖ0.01mol£¬x:y=0.01£ŗ0.015=2£ŗ3£¬¼“2CuCO3”¤3Cu(OH)2”£


 ¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø
¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø Ó¢²Å¼Ę»®Ķ¬²½æĪŹ±øߊ§ŃµĮ·ĻµĮŠ“š°ø
Ó¢²Å¼Ę»®Ķ¬²½æĪŹ±øߊ§ŃµĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗćĪĀŗćČŻĻĀ£¬½«2 mol AĘųĢåŗĶ2 mol BĘųĢåĶØČėĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśČēĻĀ·“Ó¦£ŗ2A(g)£«B(g)![]() xC(g)£«2D(s)£¬2 minŹ±·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬“ĖŹ±Ź£Óą1.2 mol B£¬²¢²āµĆCµÄÅضČĪŖ1.2 mol”¤L£1”£
xC(g)£«2D(s)£¬2 minŹ±·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬“ĖŹ±Ź£Óą1.2 mol B£¬²¢²āµĆCµÄÅضČĪŖ1.2 mol”¤L£1”£
£Ø1£©x£½________”£
£Ø2£©“ÓæŖŹ¼·“Ó¦ÖĮ“ļµ½Ę½ŗāדĢ¬£¬Éś³ÉCµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ________”£
£Ø3£©AµÄ×Ŗ»ÆĀŹÓėBµÄ×Ŗ»ÆĀŹÖ®±ČĪŖ________”£
£Ø4£©Ę½ŗāŗóAµÄĢå»ż·ÖŹżĪŖ£ŗ___________ ”£
£Ø5£©·“Ó¦Ē°ÓėĘ½ŗāŗóµÄŃ¹ĒæÖ®±ČĪŖ________ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖH2(g)+Br2(l)=2HBr(g)£»”÷H=-72kJ/mol£®Õō·¢1mol Br2(l)ŠčŅŖĪüŹÕµÄÄÜĮæĪŖ30kJ£¬ĘäĖüĻą¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
»ÆѧĪļÖŹ | H2(g) | Br2(g) | HBr(g) |
1mol·Ö×ÓÖŠµÄ»Æѧ¼ü¶ĻĮŃŹ±ŠčŅŖĪüŹÕµÄÄÜĮæ/KJ | 436 | a | 369 |
Ōņ±ķÖŠaĪŖ£Ø””””£©
A£®404 B£®260 C£®230 D£®200
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ę”¢l0lkPaĻĀ£¬ĆŗĢ攢ĒāĘų”¢ĢģČ»ĘųŗĶ¼×“¼£ØCH3OH)ĖÄÖÖČ¼ĮĻµÄČČÖµ(ÖøŅ»¶ØĢõ¼žĻĀ£¬µ„Ī»ÖŹĮæµÄĪļÖŹĶźČ«Č¼ÉÕĖł·Å³öµÄČČĮæ)ŅĄ“ĪŹĒ33kJ”¤g-1”¢143 kJ”¤g-1”¢56 kJ”¤g-1”¢23 kJ”¤g-1”£ŌņĻĀĮŠČČ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ
A. C(s)+l/2O2(g)=CO(g) ”÷H= -396kJ”¤mol-1
B. 2H2(g)+O2(g)=2H2O(l) ”÷H= -286 kJ”¤mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ”÷H= -896 kJ”¤mol-1
D. CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ”÷H= -736 kJ”¤mol-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜŌ“ŹĒČĖĄąÉś»īŗĶÉē»į·¢Õ¹µÄ»ł“”£¬ŃŠ¾æ»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ£¬ÓŠÖśÓŚøüŗƵŲĄūÓĆ»Æѧ·“Ó¦ĪŖÉś²śŗĶÉś»ī·žĪń”£
(1)ĢģČ»ĘųŗĶæÉČ¼±ł(mCH4”¤nH2O)¼ČŹĒøߊ§½ą¾»µÄÄÜŌ“£¬Ņ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬
¢Ł¼×Ķé·Ö×ÓµÄæռ乹ŠĶĪŖ__________£¬æÉČ¼±ł(mCH4”¤nH2O)ŹōÓŚ________¾§Ģ唣
¢ŚŅŃÖŖ25”ę”¢101kPaŹ±£¬1g¼×ĶéĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®·Å³ö55.65kJČČĮ棬ŌņøĆĢõ¼žĻĀ·“Ó¦
CH4(g)+2O2(g)=CO2(g)+2H2O(l)µÄ”÷H=______kJ”¤mol-1
(2)ÓĆ¼×Ķé-ŃõĘų¼īŠŌ(KOHČÜŅŗ)Č¼ĮĻµē³Ų×÷µēŌ“£¬µē½āCuCl2ČÜŅŗ”£·“ӦװÖĆČēĻĀĶ¼ĖłŹ¾£ŗ
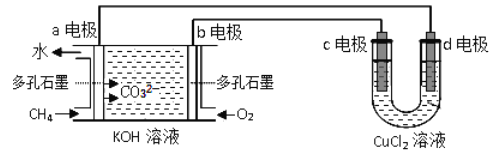
¢Łbµē¼«Ćū³ĘĪŖ___________£¬dµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ_________”£
¢Ś¼ŁÉčCuCl2ČÜŅŗ×ćĮ棬µ±Ä³µē¼«ÉĻĪö³ö3.2g½šŹōCuŹ±£¬ĄķĀŪÉĻČ¼ĮĻµē³ŲĻūŗÄŃõĘųŌŚ±ź×¼×“æöĻĀµÄĢå»żŹĒ______ mL”£
(3)ŌŚĻąĶ¬Ģõ¼žĻĀ£¬ĻĀĆęø÷×éČČ»Æѧ·½³ĢŹ½ÖŠ£¬”÷H1<”÷H2µÄŹĒ________”£(Ģī×ÖÄø)
A×é£ŗ2H2(g)+O2(g)=2H2O(g) ”÷H1 2H2(g)+O2(g)ØT2H2O(l) ”÷H2
B×é£ŗS(g)+O2(g)=SO2(g) ”÷H1 S(s)+O2(g)=SO2(g) ”÷H2
C×é£ŗC(s)+1/2O2(g)=CO(g) ”÷H1 C(s)+O2(g)=CO2(g) ”÷H2
D×é£ŗCO(g)+1/2O2(g)=CO2(g) ”÷H1 2CO(g)+O2(g)=2CO2(g) ”÷H2
(4)25”ę£¬10lkPaĢõ¼žĻĀ£¬14gN2ŗĶ3gH2Ӧɜ³ÉNH3µÄÄÜĮæ±ä»ÆČēĻĀĶ¼ĖłŹ¾£ŗ
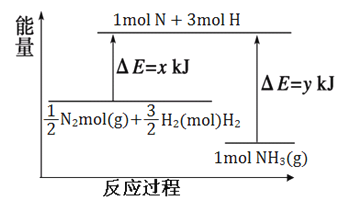
¼ŗÖŖ£ŗ¢Łx=1127£»
¢Ś25”ę101kPaĻĀ£¬N2(g)+3H2(g)![]() 2NH3(g) ”÷H=-92kJ”¤mol-1”£Ōņy=___________”£
2NH3(g) ”÷H=-92kJ”¤mol-1”£Ōņy=___________”£
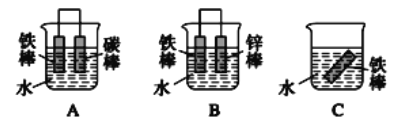
(5)½šŹō²ÄĮĻµÄøÆŹ“ŹĒČĖĄąĆęĮŁµÄŃĻÖŲĪŹĢā£¬½šŹōµÄ·ĄøƶŌ½ŚŌ¼ÄÜŌ“”¢±£»¤»·¾³Ęš×ÅŹ®·ÖÖŲŅŖµÄ×÷ÓĆ”£ĻĀĮŠČżøö×°ÖĆÖŠ£¬Ģś±»øÆŹ“ĖŁĀŹÓÉæģµ½ĀżµÄĖ³ŠņĪŖ_________(Ģī×ÖÄø)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬·Ö±š½«ĖÄæéŠĪד»ł±¾ĻąĶ¬£¬ÖŹĮæ¾łĪŖ9 gµÄĢśæéĶ¬Ź±Ķ¶Čėµ½ĻĀĮŠĖÄÖÖČÜŅŗÖŠ£¬²śÉśĒāĘųĖŁĀŹ×īæģµÄŹĒ(””””)
A. 200 mL 2 mol”¤L£1ŃĪĖį B. 50 mL 2 mol”¤L£1H2SO4ČÜŅŗ
C. 100 mL 3 mol”¤L£1ŃĪĖį D. 500 mL 6 mol”¤L£1HNO3ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹÆÓĶ·ÖĮ÷²śĘ·Õż¶”ĶéæÉŅŌ°“ŅŌĻĀŗĻ³ÉĀ·Ļß½ųŠŠ×Ŗ»Æ£ØÉś³ÉĪļÖŠµÄĪŽ»śĪļŗöĀŌ£©

ĢįŹ¾£ŗ
ĪŹĢā£ŗ
£Ø1£©DÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³Ę£ŗ_____________
£Ø2£©ĻĀĮŠ·“Ó¦ÖŠŹōÓŚČ”“ś·“Ó¦µÄŹĒ£ŗ______________
A.¢Ł B.¢Ś C.¢Ü D.¢Ż
£Ø3£©Š“³ö·“Ó¦¢ßµÄ»Æѧ·½³ĢŹ½£ŗ________________
Š“³ö·“Ó¦¢ąµÄ»Æѧ·½³ĢŹ½£ŗ___________________
£Ø4£©øß¾ŪĪļXµÄ½į¹¹¼ņŹ½£ŗ_________________
£Ø5£©AŹĒÖ±Į“½į¹¹£¬æÉŅŌŹ¹Br2µÄCCl4ČÜŅŗĶŹÉ«£¬Éś³ÉµÄ²śĪļ×ī¶ąÓŠ__________ÖÖ
£Ø6£©ÓėG¾ßÓŠĻąĶ¬¹ŁÄÜĶŵÄĶ¬·ÖŅģ¹¹ĢåÓŠ___________ÖÖ
£Ø7£©·“Ó¦¢ŪµÄÄæµÄŹĒ_____________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖH+£Øaq£©+OH£(aq) =H2O(l) ¦¤H=£57.3 kJ”¤mol-1£¬»Ų“šĻĀĮŠĪŹĢā”£

£Ø1£©ŅĒĘ÷AµÄĆū³Ę____ ___£»ĖéÅŻÄĖÜĮĻµÄ×÷ÓĆŹĒ___________________”£
£Ø2£©»·ŠĪ²£Į§½Į°č°ō²»ÄÜÓĆ»·ŠĪĶÖŹ½Į°č°ō“śĢę£¬ĘäŌŅņŹĒ______________ ”£
£Ø3£©ČōĶعżŹµŃé²ā¶ØÖŠŗĶČȵĦ¤HµÄ¾ų¶ŌÖµ³£³£Š”ÓŚ57.3 kJ/mol£¬ĘäŌŅņæÉÄÜŹĒ_______
a£®ŹµŃé×°ÖƱ£ĪĀ”¢øōČČŠ§¹ū²ī
b£®ĮæČ”NaOHČÜŅŗµÄĢå»żŹ±ŃöŹÓ¶ĮŹż
c£®·Ö¶ą“Ī°ŃNaOHČÜŅŗµ¹ČėŹ¢ÓŠŃĪĖįµÄŠ”ÉÕ±ÖŠ
d£®ÓĆĪĀ¶Č¼Ę²ā¶ØŃĪĖį³õŹ¼ĪĀ¶Čŗó£¬Ö±½Ó²ā¶ØĒāŃõ»ÆÄĘČÜŅŗµÄĪĀ¶Č
(4)½«V1mL1.0mol”¤L-1HClČÜŅŗŗĶV2mLĪ“ÖŖÅØ¶ČµÄNaOHČÜŅŗ»ģŗĻ¾łŌČŗó²āĮæ²¢¼ĒĀ¼ČÜŅŗĪĀ¶Č£¬ŹµŃé½į¹ūČēÓŅĶ¼ĖłŹ¾£ØŹµŃéÖŠŹ¼ÖÕ±£³ÖV1£«V2£½50mL£©”£ÓÉĻĀĶ¼æÉÖŖ£¬ĒāŃõ»ÆÄʵÄÅضČĪŖ £»

¼ŁÉčŃĪĖįÓėĒāŃõ»ÆÄĘĘšŹ¼ĪĀ¶ČĘ½¾łÖµĪŖ21.0”ę£¬Ķ¼ÖŠ×īøßĪĀ¶ČĪŖ28.0”ę£¬²¢½üĖĘČĻĪŖNaOHČÜŅŗŗĶŃĪĖįČÜŅŗµÄĆܶȶ¼ŹĒ1 g/cm3£¬ÖŠŗĶŗóÉś³ÉČÜŅŗµÄ±ČČČČŻc="4.18" J/(g”¤”ę)”£ŌņÖŠŗĶČȦ¤H = £ØČ”Š”ŹżµćŗóŅ»Ī»£©”£ £ØĢįŹ¾£ŗQ=cm¦¤t£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬½«Ņ»ŌŖĖįHAµÄČÜŅŗŗĶKOHČÜŅŗµČĢå»ż»ģŗĻ(ŗöĀŌĢå»ż±ä»Æ)£¬ŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ
| ĘšŹ¼ÅضČ/(mol”¤L-1) | ·“Ó¦ŗóČÜŅŗµÄpH | |
c(HA) | c(KOH) | ||
¢Ł | 0.1 | 0.1 | 9 |
¢Ś | x | 0.2 | 7 |
ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ( )
A£®ŹµŃé¢Ł·“Ó¦ŗóµÄČÜŅŗÖŠ£ŗc(K+)>c(A-)>c(OH-)>c(H+)
B£®ŹµŃé¢Ł·“Ó¦ŗóµÄČÜŅŗÖŠ£ŗc(OH-)=c(K+)-c(A-)=![]() mol”¤L-1
mol”¤L-1
C£®ŹµŃé¢Ś·“Ó¦ŗóµÄČÜŅŗÖŠ£ŗc(A-)+c(HA)>0.1 mol”¤L-1
D£®ŹµŃé¢Ś·“Ó¦ŗóµÄČÜŅŗÖŠ£ŗc(K+)=c(A-)>c(OH-)=c(H+)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com