
麻醉剂的发现和使用,是人类历史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛.
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一.有关理论认为N2O与CO2具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为________,其空间构型是________型,由此可见它是________分子(填“极性”或“非极性”)
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气(COCl2)∶2CHCl3+O2→2HCl+2COCl2,为防止中毒事故,使用前可用于检验氯仿是否变质的试剂是________.
| A.酚酞试液 | B.淀粉碘化钾溶液 | C.NaOH溶液 | D.硝酸银稀溶液 |
(8分)(1)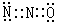 (2分);直线(1分);极性(1分) (2)D(2分) (3)XeF4 (2分)
(2分);直线(1分);极性(1分) (2)D(2分) (3)XeF4 (2分)
解析试题分析:(1)N2O与CO2具有相似的结构(包括电子式),且N2O分子中氧原子只与一个氮原子相连,所以根据CO2的结构简式O=C=O可知,N2O的电子式可表示为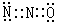 。CO2是直线型结构,因此N2O分子也是直线型结构。由于氮氧双键和氮氮双键不同,所以N2O分子极性分子。
。CO2是直线型结构,因此N2O分子也是直线型结构。由于氮氧双键和氮氮双键不同,所以N2O分子极性分子。
(2)根据发生反应的化学方程式2CHCl3+O2→2HCl+2COCl2可知,产物中有HCl气体产生,氯化氢能和酸化的硝酸银溶液反应生成氯化银白色沉淀,而氯仿和酸化的硝酸银溶液不反应,据此可以检验氯仿是否变质,因此正确的答案选D。
(3)参加反应的氟气是3.5mol-1.5mol=2.0mol,则根据原子守恒可知,该白色固体中Xe和F原子的个数之比是1:4,即化学式是XeF4。
考点:考查电子式、分子空间构型、分子极性的判断、氯离子的检验和物质化学式的确定


科目:高中化学 来源: 题型:填空题
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。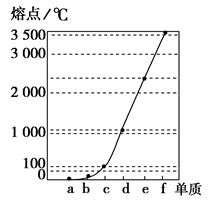
(1)请写出上图中d单质对应元素原子的电子排布式_________________________。
(2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含__________个σ键,__________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为__________;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为____________,其中X与d的高价离子之间以____________键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为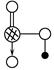 ,请简要说明该物质易溶于水的原因________________________________。
,请简要说明该物质易溶于水的原因________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为_________。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为_________、__________、_________,推测盐中阴离子的空间构型为__________,其中心原子杂化方式为__________。
(3)Z、W两种元素电负性的大小关系为____;Y、Z两种元素第一电离能的大小关系为____。
(4)CO的结构可表示为C O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):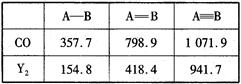
①结合数据说明CO比Y2活泼的原因:_____。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是_____。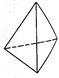
A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是______,该化合物由______键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是________。
(3)Na3N与水的反应属于____________反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:r(Na+)________r(N3-)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
判断下列四句话的对错,并且说出理由:
(1)离子键只存在于离子化合物中
(2)离子化合物一定含离子键
(3)离子化合物中一定不存在分子
(4)离子化合物不一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知NaCl、CsCl晶体结构中离子配位数分别为6和8,其中属于从NaCl晶体中分割出来的结构示意图是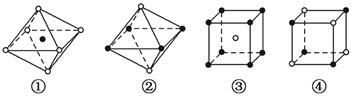
| A.①和③ | B.①和④ | C.只有③ | D.只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性,因这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为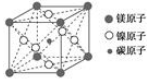
| A.Mg2CNi3 | B.MgCNi3 | C.MgCNi2 | D.MgC2Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是(NA为阿伏加德罗常数)( )
| A.28 g晶体硅中含有Si—Si键的个数为2NA |
| B.124 g白磷(P4)晶体中含有P—P键的个数为4NA |
| C.12 g金刚石中含有C—C键的个数为4NA |
| D.SiO2晶体中每1 mol Si可与氧原子形成2NA个共价键(Si—O键) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com