
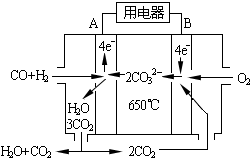
 (6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-.
(6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-. 分析 (1)氨气是碱性气体,可以和酸反应生成盐;
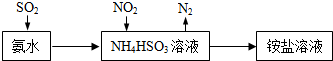
(2)二氧化硫与氨水反应生成亚硫酸氢铵;
二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气;
(3)已知:①N2(g)+O2(g)=2NO(g)△H1
②2C(s)+O2(g)=2CO(g)△H2
③C(s)+O2(g)=CO2(g)△H3
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),反应热也进行相应的计算;
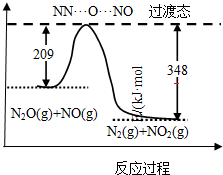
(4)由图可知,此反应为放热反应,热效应=(209-348)kJ•mol-1;
(5)①根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比;
②根据过多的NO不能与Na2CO3溶液反应;
(6)碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,氧气在该电极上发生还原反应.
解答 解:(1)氨气是碱性气体,可以和磷酸反应生成盐,产生的盐随着酸的磷酸的量的多少而不同,可以产生磷酸铵,磷酸氢铵或是磷酸二氢铵,
故答案为:(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4);
(2)二氧化硫与氨水反应生成亚硫酸氢铵,离子方程式:NH3•H2O+SO2=NH4++HSO3-;
二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气,离子方程式:2NO2+4HSO3-=N2+4SO42-+4H+;
故答案为:NH3•H2O+SO2=NH4++HSO3-;2NO2+4HSO3-=N2+4SO42-+4H+;
(3)已知:①N2(g)+O2(g)=2NO(g)△H1
②2C(s)+O2(g)=2CO(g)△H2
③C(s)+O2(g)=CO2(g)△H3
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),所以△H=2△H3-△H2-△H1,
故答案为:2△H3-△H2-△H1;
(4)由图可知,此反应反应物总能量高于生成物,且△H=209-348=-139kJ•mol-1,
故答案为:-139;
(5)①设NO的物质的量是x,NO2的物质的量是y,则:x+$\frac{y-x}{2}$=$\frac{22.4}{22.4L/mol}$mol、32x+24(y-x)=44,
解得:x=$\frac{1}{4}$,y=$\frac{7}{4}$;即一氧化氮和二氧化氮的物质的量之比$\frac{1}{4}$:$\frac{7}{4}$=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,
故答案为:1:7.
②NO不能与Na2CO3溶液反应,所以对于含NO较多混合气体无法完全吸收,
故答案为:含NO较多混合气体无法完全吸收;
(6)碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,氧气在该电极上发生还原反应,
故答案为:负;2CO2+O2+4e-=2CO32-.
点评 本题考查了电解原理、盖斯定律的应用、化学方程式的计算等知识,题目难度较大,明确盖斯定律的含义、原电池工作原理为解答关键,试题知识点较多、综合性较强,充分考查了学生分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述两个反应都是置换反应 | |
| B. | 反应①中若有1mol Br2生成,则转移电子的物质的量为2mol | |
| C. | 氧化性由强到弱顺序为:KClO3>Cl2>Br2 | |
| D. | 反应②中还原剂与氧化剂的物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| C(H+)mol•L-1 | C(OH-)mol•L-1 | PH | |
| 溶液1 | 1×10-4 | 1×10-10 | 4 |
| 溶液2 | 1×10-7 | 1×10-7 | 7 |
| 溶液3 | 1×10-9 | 1×10-5 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

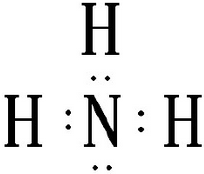 .向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
.向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
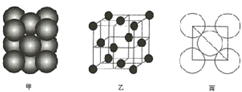 A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
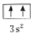 违背了泡利原理.
违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com