
| m |
| M |
| 50.8g |
| 254g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、CO2能使苯酚钠溶液变浑浊,稀HCl也能使苯酚钠溶液变浑浊 |
| B、NH4HCO3溶液呈碱性,NH4HSO4溶液也呈碱性 |
| C、CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
| D、常温下,Al在浓硫酸中无明显变化,Mg在浓硫酸中也无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NH4+:试液
| |||||
B、I-:试液
| |||||
C、HCO3-:试液
| |||||
D、Fe2+:试液
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑦⑧ | B、①②④⑤ |
| C、①②⑤⑥ | D、③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、v(O2)=
| ||
B、v(H2O)=
| ||
C、v(H2O)=
| ||
D、v(NO)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 代号 | a | b | c | d | e |
| 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
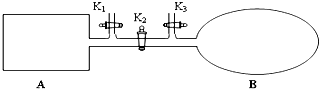 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com