
| A. | 12 | B. | 11 | C. | 7 | D. | 3 |
分析 pH=2的HCl溶液中氢离子浓度等于0.01mol/L,pH=13的NaOH溶液中氢氧根离子浓度为0.1mol/L,盐酸与氢氧化钠溶液按9:1混合,发生反应H++OH-=H2O,反应后氢氧化钠有剩余,溶液呈碱性,计算混合后溶液中c(OH-),再根据Kw=c(H+)•c(OH-)=10-14计算c(H+),根据pH=-lgc(H+)计算.
解答 解:pH=2的HCl溶液中氢离子浓度等于0.01mol/L,pH=13的NaOH溶液中氢氧根离子浓度为0.1mol/L,盐酸与氢氧化钠溶液按9:1混合,发生反应H++OH-=H2O,0.1×1>0.01×9,反应后氢氧化钠有剩余,溶液呈碱性,故反应后溶液中c(OH-)=$\frac{0.1×1-0.01×9}{1+9}$mol/L=0.001mol/L,故c(H+)=$\frac{1{0}^{-14}}{0.001}$mol/L=10-11mol/L,故反应后溶液pH=-lgc(H+)=-lg10-11=11,
故选B.
点评 本题考查酸碱混合反应后溶液PH的计算,明确混合后溶液显碱性是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.1gCl2含有的Cl2分子数为0.2NA | |
| B. | 0.1 mol羟基(-OH)含有的电子数为NA | |
| C. | 1.7gNH3含有的电子数为NA | |
| D. | 标准状况下,11.2LSO3中含有的氧原子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一氧化碳中毒者移到通风处抢救 | |
| B. | 眼睛里不慎溅进了药液,应立即用水冲洗,并且用手使劲揉眼睛 | |
| C. | 不慎将浓硫酸溅到皮肤上,应立即用大量水冲洗 | |
| D. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者均属于无机物 | |
| B. | 二者均属于混合物 | |
| C. | 前者属于有机高分子化合物,后者属于无机酸铵盐 | |
| D. | 前者属于有机高分子化合物,后者属于有机酸铵盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
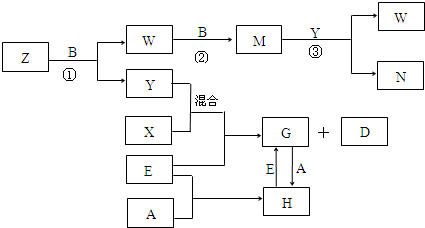
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Ag+、Cl- | B. | Ca2+、NO3-、Mg2+ | C. | Na+、CO32-、Fe2+ | D. | Cu2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
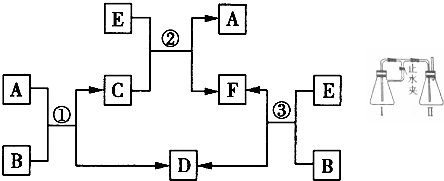
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
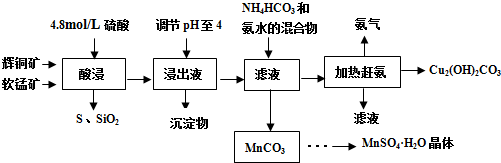
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com