
| A. | 等量的硫蒸气和硫固体分别完全燃烧,前者反应速率快,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.9 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H1=-57.3 kJ•mol-1,若含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2,则△H1>△H2 | |
| D. | 在101 kPa时,10g H2完全燃烧生成液态水,放出1429 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-517.6 kJ•mol-1 |
分析 A、硫蒸气所含能量比硫固体高;
B、能量越低越稳定;
C、醋酸为弱酸,电离要吸热,所以含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2>△H1;
D、10g H2完全燃烧生成液态水,放出1429 kJ热量,则2mol即4g氢气完全燃烧生成液态水,放出$\frac{1429}{10}$×4=517.6kJ热量;
解答 解:A、硫蒸汽所含能量比硫固体高,所以,等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量多,故A错误;
B、从热化学方程式看,石墨能量低,物质所含能量越低越稳定,则石墨比金刚石稳定,故B正确;
C、醋酸为弱酸,电离要吸热,所以含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2>△H1,故C错误;
D、10g H2完全燃烧生成液态水,放出1429 kJ热量,则2mol即4g氢气完全燃烧生成液态水,放出$\frac{1429}{10}$×4=517.6kJ热量,所以热化学方程式应为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,故D正确;
故选BD.
点评 本题考查了物质的状态不同时能量不同、能量越低越稳定、燃烧热、中和热等等,注意:
1、物质的三态变化与能量的关系;
2、物质的能量越低越稳定;
3、热化学方程式书写中,化学计量数与△H数值的对应;
4、中和热是指强酸强碱的稀溶液中和.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:填空题
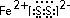 .
.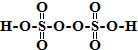
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(硝基苯):加少量蒸馏水振荡,待分层后分液 | |
| B. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| C. | 乙烷(乙烯):通入氢气发生加成反应 | |
| D. | 乙醇(水):加新制的生石灰,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
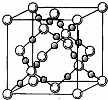 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题: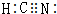
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中一共有16个纵行 | |
| B. | 除零族元素外,非金属元素全都是主族元素 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氟的气化和液溴的气化 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com