
【题目】利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2,工艺流程如下:

回答下列问题
(1)“浸取”实验中,反应体系的温度、反应时间对锰脱除效果的影响如下表,则适合的温度和反应时间分别是________、________。
表1 温度对锰脱除效果的影响
温度/℃ | ρ(Mn2+)/mg/L | 除锰率/% |
10 | 0.325 | 87.9 |
30 | 0.341 | 89.5 |
50 | 0.424 | 84.3 |
70 | 0.646 | 76.1 |
表2 反应时间对锰脱除效果的影响
时间/h | ρ(Mn2+)/mg/L | 除锰率/% |
1.0 | 0.995 | 63.1 |
1.5 | 0.794 | 70.6 |
2.0 | 0.328 | 87.9 |
2.5 | 0.325 | 87.9 |
(2)“滤渣1”的主要成分是________。
(3)H2O2溶液的作用是___________,已知“滤渣2”的主要成分是Fe(OH)3,则氧化锌的作用是____________。“置换”实验中发生反应的离子方程式有Zn+Pb2+=Pb+Zn2+、_________。
(4)由锌灰制取金属锌可采用碱溶解,然后电解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2,则阴极的电极反应为____________________________________________。
(5)ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46 g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为________________。
【答案】30℃ 2.0h MnO2 将Fe2+氧化为Fe3+ 调节pH将Fe3+转化为沉淀除去 Zn+Cu2+=Zn2++Cu [Zn(OH)4]2+2e=Zn+4OH Zn3CO3(OH)4
【解析】
锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)加入稀盐酸酸浸,MnO2不溶液于稀盐酸,过滤后得到的滤渣1为MnO2,滤液中含有Zn2+、Fe2+、Cu2+、Pb2+等,加入H2O2可氧化溶液中的Fe2+生成Fe3+,发生H2O2+2Fe2++2H+=2Fe3++2H2O,加入ZnO调节溶液pH除去Fe3+,过滤后滤渣2为Fe(OH)3,滤液中含有等Zn2+、Cu2+、Pb2+等,加入Zn置换出Cu、Pb,经过滤后滤液中主要含有Zn2+;
(1)根据表格中数据,确定“浸取”实验中,锰脱除效果最佳时反应体系的温度、反应时间;
(2)酸浸时,锌灰中ZnO、PbO、FeO、CuO均溶于稀盐酸,而MnO2不溶于稀盐酸;
(3)H2O2溶液有强氧化性,能氧化溶液中的Fe2+;Fe3+在溶液中易水解,加入ZnO能促进Fe3+水解;在含有Cu2+、Pb2+的溶液中加入Zn,可置换出Cu和Pb;
(4)石墨作电极电解时,阳极氢氧根离子失电子,阴极上[Zn(OH)4]2-得电子;
(5)浓硫酸增重为分解生成水的质量,碱石灰增重为分解得到二氧化碳的质量,结合原子守恒计算碳酸根、氢氧根的物质的量,再结合电荷守恒计算Zn2+的物质的量,计算x、y、z的比例关系确定化学式。
(1)结合温度、时间对锰脱除效果的影响数据,可知温度为30℃、时间为2小时时除锰率最高,故答案为:30℃;2.0h;
(2)含MnO2的锌灰用稀盐酸溶解时,MnO2不溶于稀盐酸,经过滤可除去,即滤渣1为MnO2;
(3)向含有Zn2+、Fe2+、Cu2+、Pb2+的滤液中,加入H2O2可氧化溶液中的Fe2+生成Fe3+;向含Fe3+的溶液中加入ZnO,调节溶液pH,促进Fe3+水解生成Fe(OH)3沉淀除去;在含有Cu2+、Pb2+的溶液中加入Zn,可置换出Cu和Pb,发生的离子反应包括:Zn+Pb2+=Pb+Zn2+、Zn+Cu2+=Zn2++Cu,所以答案为:将Fe2+氧化为Fe3+;调节pH将Fe3+转化为沉淀除去;Zn+Cu2+═Zn2++Cu;
(4)石墨作电极电解时,阳极氢氧根离子失电子生成O2,阴极上[Zn(OH)4]2-得电子生成Zn,则阴极的电极方程式为:[Zn(OH)4]2-+2e--=Zn+4OH-;
(5)浓硫酸增重为分解生成水的质量,水的物质的量为n(H2O)=![]() =0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到CO2的质量,CO2物质的量为n(CO2)=
=0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到CO2的质量,CO2物质的量为n(CO2)=![]() =0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2+)=
=0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2+)=![]() ×(0.08mol+0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为:Zn3CO3(OH)4。
×(0.08mol+0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为:Zn3CO3(OH)4。


科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
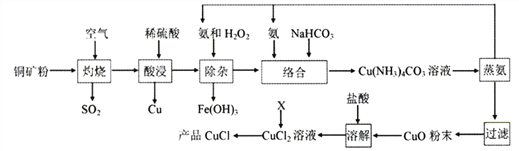
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:

(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO310H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G(对羟基苯乙酸)是合成某治疗高血压药物的中间体。一种由芳香烃A制备G的合成路线如下图所示。

请回答下列问题:
(1)A的名称为___________。
(2)试剂M是___________。B→C的反应类型是___________。
(3)E的结构简式为___________。F中含有官能团的名称是___________。
(4)写出D→E反应的化学方程式:___________。
(5)H是G的同分异构体,且满足下列条件:①与FeCl3溶液发生显色反应;②核磁共振氢谱有5组峰,峰面积之比为1︰2︰2︰2︰1。请写出3个符合条件的H的结构简式:___________。
(6)苯甲酸可用于染料载体、香料及增塑剂等的生产。参考题目中的有关信息,设计由苯制备苯甲酸的合成路线(无机试剂自选):___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是

A. Al电极区的电极反应式:A1-3e-+3NH3·H2O=Al(OH)3+3NH4+
B. 石墨电极上的电势比Al电极上的低
C. 每消耗27gAl,有3mol电子通过溶液转移到石墨电极上
D. 若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com