
世界环保联盟即将全面禁止在自来水中加氯气(Cl2,黄绿色气体),推广采用光谱高效消毒剂二氧化氯,目前欧州和 我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同
我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同 时会产生Cl2.该法制ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
时会产生Cl2.该法制ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(1)该反应中,氧化剂为____________,氧化产物为____________.
(2)若反应生成0.1mol Cl2,则转移的电子的物质的量为____________.
(3)盐酸在反应中显示出来的性质是:(填写编号)____________.
①还原性 ②还原性、酸性 ③氧化性 ④氧化性、酸性.
(4)由化学方程式可以推出:还原性大小比较:HCl>____________
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源:2016-2017学年贵州省高二上月考二化学试卷(解析版) 题型:选择题
如图表 示溶液中c(H+)和c(O
示溶液中c(H+)和c(O H-)的关系,下列判断错误的是:
H-)的关系,下列判断错误的是:
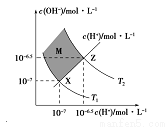
A.两条曲线间任意点均有c(H+)×c(OH-)=KW
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省定州市高一上学期期中化学试卷(解析版) 题型:填空题
现有下列物质:①NaCO3•10H2O晶体 ②铜 ③硫酸 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质属于硫酸盐的有_______________(填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式__________________________。
(3)⑩溶于水电离方程式Al2(SO4)317.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为_____________。
(4)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时的离子方程式__________。
(5)②与⑨发生反 应的化学方程式为:3Cu+8HNO3=3Cu(NO
应的化学方程式为:3Cu+8HNO3=3Cu(NO 3)2+2NO↑+4H2O当有0.6mol电子转移时,生成的气体标准状况下的体积为 L
3)2+2NO↑+4H2O当有0.6mol电子转移时,生成的气体标准状况下的体积为 L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省定州市高一上学期期中化学试卷(解析版) 题型:选择题
对四组无色透明溶液进行离子检验,四位同 学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是( )
学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是( )
A.Mn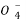 、K+、S2-、Na+ B.Mg2+、N
、K+、S2-、Na+ B.Mg2+、N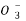 、OH-、Cl-
、OH-、Cl-
C.K+、H+、Cl-、C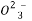 D.Na+、OH-、Cl-、N
D.Na+、OH-、Cl-、N
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省定州市高一上学期期中化学试卷(解析版) 题型:选择题
下列关于FeCl3溶液和Fe(OH)3胶体的说法中正确的是( )
A.都是无色透明、均一、稳定的分散系 B.分散质颗粒直径都在1~100 nm之间
C.Fe(OH)3胶体具有丁达尔效应 D.FeCl3溶液具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:选择题
下列实验设计方案中,可行的是( )
A.用加入适量铜粉的方法除去Mg(NO3)2溶液中混有的AgNO3
B.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
C.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42-
D.先滴加石蕊试液,后滴加BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:选择题
离子方程式:CO32-+2H2+=CO2↑+H2O表示 ( )
A.碳酸盐和盐酸盐之间的反应
B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与酸之间的反应
D.可溶性碳酸盐与强酸之间的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上学期期中化学试卷(解析版) 题型:填空题
(1)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是 ,氧化产物是 。
②该反应中被氧化的物质与被还原的物质物质的量之比为 。
③用单线桥法标出点子转移的方向与数目。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O.已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 ,还原剂是 。
②该反应中1mol氧化剂 (填“得到”或“失去”) mol电子。
③当有0.1molHNO3被还原,此时生成标准状况下NO的体积是 L。
④请把各物质填在下面空格处,需配平:
□______+□______=□______+□______+□______+□
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:实验题
定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=__________KJ/mol。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式 。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为: (用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为 mL。
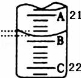
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C= mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com