
【题目】环丁基甲酸是重要的有机合成中间体,以下是用烯烃![]() 和羧酸
和羧酸![]() 合成环丁基甲酸的路线:
合成环丁基甲酸的路线:
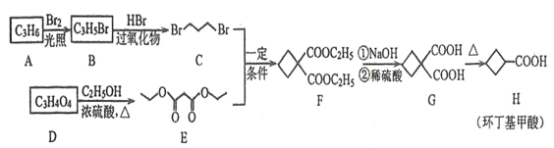
回答下列问题:
(1)![]() 的结构简式为______________。
的结构简式为______________。
(2)![]() 中官能团的名称为______________。
中官能团的名称为______________。
(3)![]() 的化学方程式为______________,反应类型为______________。
的化学方程式为______________,反应类型为______________。
(4)![]() 的化学方程式为__________。
的化学方程式为__________。
(5)![]() 的分子式为______,
的分子式为______,![]()
![]() 与足量碳酸氢钠溶液反应生成
与足量碳酸氢钠溶液反应生成![]() 的物质的量为____
的物质的量为____![]() 。
。
(6)满足下列条件的![]() 的所有同分异构体(不考虑立体异构)共有______种,其中核磁共振氢谱有3组峰的结构简式为_________。
的所有同分异构体(不考虑立体异构)共有______种,其中核磁共振氢谱有3组峰的结构简式为_________。
①能使溴的四氯化碳溶液褪色
②能与![]() 溶液反应
溶液反应
③能与银氨溶液发生银镜反应
④不含环状结构
【答案】![]() 碳碳双键、溴原子
碳碳双键、溴原子 ![]() 加成反应 BrCH2CH2CH2Br+
加成反应 BrCH2CH2CH2Br+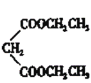
![]()
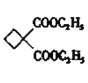 +2HBr
+2HBr ![]() 2 8
2 8 ![]()
【解析】
根据图示转化关系,A→B为取代反应,B→C为加成反应,结合A、B的分子式和C的结构简式可知,A的结构简式为CH3CH=CH2,B的结构简式为BrCH2CH=CH2;D在浓硫酸加热条件下与CH3CH2OH发生酯化反应生成E,结合E的结构简式,可得D的结构简式为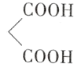 ,结合上述分析解答。
,结合上述分析解答。
(1)根据分析,![]() 的结构简式为CH3CH=CH2;
的结构简式为CH3CH=CH2;
(2)B的结构简式为BrCH2CH=CH2,含有的官能团的名称为溴原子、碳碳双键;
(3)根据分析,B→C为加成反应,化学方程式为BrCH2CH=CH2+HBr![]() BrCH2CH2CH2Br;
BrCH2CH2CH2Br;
(4)根据流程图所示,![]() 的化学方程式为BrCH2CH2CH2Br+
的化学方程式为BrCH2CH2CH2Br+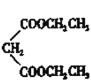
![]()
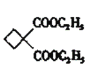 +2HBr;
+2HBr;
(5)根据![]() 的结构简式,节点为碳原子,每个碳原子形成四个共价键,不足键由氢原子补齐,分子式为C6H8O4,G的结构中含有两个羧基,则
的结构简式,节点为碳原子,每个碳原子形成四个共价键,不足键由氢原子补齐,分子式为C6H8O4,G的结构中含有两个羧基,则![]()
![]() 含有2mol羧基,与足量碳酸氢钠溶液反应生成
含有2mol羧基,与足量碳酸氢钠溶液反应生成![]() 的物质的量为2mol。
的物质的量为2mol。
(6)H的分子式为C5H8O2,根据①能使溴的四氯化碳溶液褪色,则含有碳碳不饱和键;②能与![]() 溶液反应,则含有酯基或羧基;③能与银氨溶液发生银镜反应,则含有醛基或甲酸酯基,结合上述分析和条件④可知符合条件的同分异构体含有碳碳双键和甲酸酯基,故该同分异构体可表示为HCOOC4H7,其中-C4H7中含有一个碳碳双键,由于丁烯有CH3CH2CH=CH2、(CH3)2C=CH2span>、CH3CH=CH=CH3三种结构,去掉一个氢原子的位置不同,得到的丁烯基-C4H7分别有4种、2种、2种,即-C4H7有4+2+2=8种结构,故满足条件的H的同分异构体共有8种,其中核磁共振氢谱有3组峰的结构简式为HCOOCH=C(CH3)2(或写为
溶液反应,则含有酯基或羧基;③能与银氨溶液发生银镜反应,则含有醛基或甲酸酯基,结合上述分析和条件④可知符合条件的同分异构体含有碳碳双键和甲酸酯基,故该同分异构体可表示为HCOOC4H7,其中-C4H7中含有一个碳碳双键,由于丁烯有CH3CH2CH=CH2、(CH3)2C=CH2span>、CH3CH=CH=CH3三种结构,去掉一个氢原子的位置不同,得到的丁烯基-C4H7分别有4种、2种、2种,即-C4H7有4+2+2=8种结构,故满足条件的H的同分异构体共有8种,其中核磁共振氢谱有3组峰的结构简式为HCOOCH=C(CH3)2(或写为![]() )。
)。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论不正确的是

A. 由甲可知:使用催化剂不影响反应热
B. 由乙可知:对于恒温恒容条件下的反应2NO2 (g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C. 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D. 由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同位素的是_____,互为同素异形体的是_____,互为同系物的是_____,互为同分异构体的是_____,属于同一种物质的是_____。
①金刚石与石墨 ②12C与14C ③O2与O3 ④ ⑤
⑤ ⑥
⑥ 与
与 ⑦CH2=CHCH2OH与CH3COCH3 ⑧
⑦CH2=CHCH2OH与CH3COCH3 ⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。

(1)代表金刚石的是________(填字母编号,下同),其中每个碳原子与______个碳原子最近且距离相等;金刚石属于________晶体。
(2)代表石墨的是_______,每个正六边形占有的碳原子数平均为_______个;
(3)代表NaCl的是_______,每个Na+周围与它最近且距离相等的Na+有_______个;
(4)代表CsCl的是_______,它属于_______晶体,每个Cs+与个_______Cl-紧邻;
(5)代表干冰的是_______,它属于_______晶体,每个CO2分子与_______个CO2分子紧邻;
(6)则上述五种物质熔点由高到低的排列顺序为______________(用字母编号回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
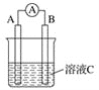
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A. 丙烷的二卤代物有4种,则其六卤代物是2种
B. 对二甲苯的一氯代物有3种
C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种
D. 某烃的同分异构体只能形成一种一氯代物,其分子式可能为C5H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 烯中C=C的键能是乙烷中C-C的键能的2倍
B. 氮气分子中含有1个s键和2个p键
C. N-O键的极性比C-O键的极性大
D. NH4+中4个N-H键的键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得较高反应速率,反应过程如图:
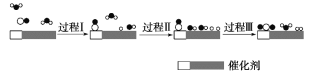
下列说法正确的是
A.若已知CO和H2的标准燃烧热,由此可推算出该反应的ΔH
B.过程Ⅰ、过程Ⅱ均为吸热过程,且吸收的热量相等
C.在该反应过程中,实际有两个H2O参与反应,断裂了三个氢氧键
D.使用催化剂降低了水煤气变换反应的ΔH,提高了反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com