
分析 (1)A.因Ni是固体,改变用量对反应物的转化率无影响;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变;
C.根据外界条件和该反应本身的特点进行分析;
D.根据不同物质的速率关系判断可逆反应时,应当一正一逆,速率之比等于系数比;
(2)分析目标反应和已知反应,运用盖斯定律即可求得目标反应的△H;
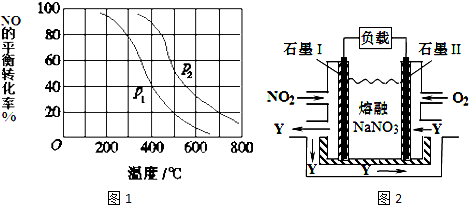
(3)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大;
②700℃时,在压强为P2时,由图象知NO平衡转化率为20%,则反应消耗NO2mol,氧气为1mol,生成二氧化氮为2mol,根据平衡时浓度的幂次方之积之比计算K;
(4)据题意,根据通入气体判断两极,电极反应式和电池反应式,根据电池总反应4NO2+O2=2N2O5,求出消耗O2的量.
解答 解:(1)A.Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,故A错误;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,故B错误;
C.因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,故C正确;
D.速率关系未说明正、逆,不能判断是否已达平衡;因该反应气体质量增加而容积不变,所以混合气体密度是一个变量,当不变时说明反应达平衡,故D错误;
故答案为:C;
(2)根据已知:①CO (g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-Q1 kJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1
则运用盖斯定律,SO2(g)+2CO(g)═S(s)+2CO2(g)可由①×2-②得到,则△H=-(2Q1-Q2) kJ•mol-1,
故答案为:-(2Q1-Q2) kJ•mol-1;
(3)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1,故答案为:p2>p1;
②700℃时,在压强为P2时,由图象知NO平衡转化率为20%,则反应消耗NO2mol,氧气为1mol,生成二氧化氮为2mol,平衡时NO为8mol,氧气为9mol,生成二氧化氮为2mol,则K=$\frac{{2}^{2}}{{8}^{2}×9}$=$\frac{1}{144}$;
故答案为:$\frac{1}{144}$;
(4)据题意,通O2一极为正极,电极反应式为O2+2N2O5+4e-=4NO3-;通NO2一极为负极,电极反应为:NO2+NO3--e-=N2O5,根据电池总反应4NO2+O2=2N2O5,收集到20molN2O5需消耗O2为10mol,标准状况下体积为224L.
故答案为:NO2+NO3--e-=N2O5;224.
点评 本题以碳和氮的化合物为载体考查化学平衡、热化学方程式及电化学的相关知识,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸的反应:Cu2++4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 氯气与水反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为1.0mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.018mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杂质在溶剂中的溶解度常温时很小,加热时很大 | |
| B. | 在室温时,产品在溶剂中易溶 | |
| C. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| D. | 在同一溶剂中,产品比杂质易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
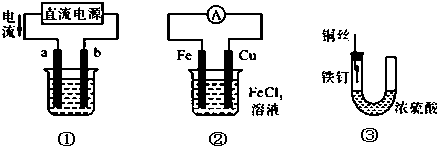
| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com