
| A. | 加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 | |
| B. | 加入催化剂,V正、V逆都发生变化,且变化的倍数相同 | |
| C. | 增大压强时,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 | |
| D. | 降低温度时,V正、V逆都减小,且V正减小倍数小于V逆减小倍数 |
分析 A.加入氩气,各物质的物质的量浓度不变,则反应速率不变;
B.催化剂能同等程度的改变正逆反应速率;
C.增大压强,平衡向正反应方向移动;
D.降低温度,平衡向吸热反应方向移动.
解答 解:A.加入氩气,各物质的物质的量浓度不变,则反应速率不变,平衡不移动,故A错误;
B.催化剂能同等程度的改变正逆反应速率,所以V正、V逆都发生变化,且变化的倍数相同,故B正确;
C.增大压强,正逆反应速率都增大,正反应速率增大倍数大于逆反应速率,所以平衡向正反应方向移动,故C正确;
D.降低温度,平衡向吸热反应方向移动,该反应的正反应是放热反应,降低温度正逆反应速率都减小,但V正减小倍数小于V逆减小倍数,平衡正向移动,故D正确;
故选A.
点评 本题考查外界条件对化学反应速率的性质,浓度、温度、催化剂等对反应速率有影响,注意改变条件时平衡移动方向,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 北京 | 92 | TSP | Ⅱ |
| 上海 | 74 | Ⅱ | |
| 济南 | 76 | TSP | Ⅱ |
| 重庆 | 98 | Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
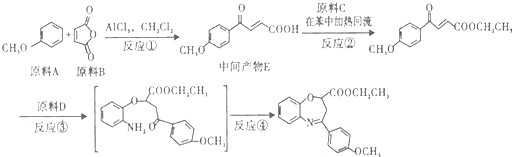
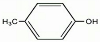 (写出其结构简式).
(写出其结构简式).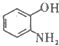 .
.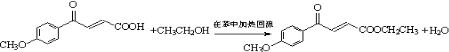 .
.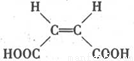 )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q: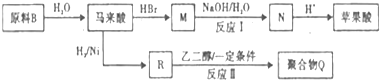
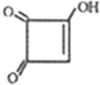 .
.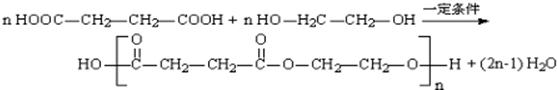 .
.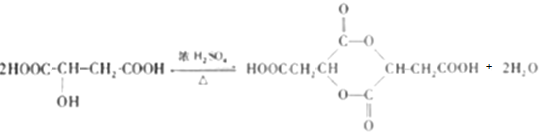 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| B. | pH=2的某酸溶液与pH=12某碱溶液等体积混合 | |
| C. | pH=2的盐酸pH=12的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( ) | 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度大于2.5 mol•L-1 | |
| C. | 第2组实验中盐酸的浓度等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度低于30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化 | |
| B. | 晶体中共价键的键长:金刚石中C-C<石墨中C-C | |
| C. | 晶体的熔点:金刚石<石墨 | |
| D. | 晶体中共价键的键角:金刚石>石墨. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是物质的化学变化都伴随着能量的变化 | |
| B. | 凡是伴随能量变化的都是化学变化 | |
| C. | 凡是放热反应都需要加热 | |
| D. | 凡是放热反应都不需要加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com