
【题目】已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
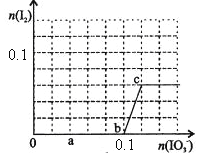
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
【答案】C
【解析】
试题还原性HSO-3>I-,所以首先发生的离子反应是3HSO3-+IO3-=3SO42-+I-+3H+。继续加入KIO3,已知氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,根据发生的反应,则:A、根据图像可知,0~b间没有单质碘生成,所以反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+,A正确;B、根据图像可知,a点碘酸钾的物质的量是0.04mol,所以根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,消耗NaHSO3的物质的量为0.04mol×3=0.12mol,B正确;C、设生成的碘单质的物质的量为n,则溶液中I—的物质的量是2.5n。则根据反应IO3-+6H++5I-=3H2O+3I2可知,消耗的KIO3的物质的量为![]() ,消耗碘离子的量为
,消耗碘离子的量为![]() 。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-
。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-![]() =2.5n,解得
=2.5n,解得![]() =
=![]() mol,所以消耗碘酸钾的物质的量是(
mol,所以消耗碘酸钾的物质的量是(![]() +0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
+0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A.图甲是常温下用 0.1000 mol·L-1 NaOH 溶液滴定 20.00mL 0.1000 mol·L-1 CH3COOH 的滴定曲线,说明 Q 点表示酸碱中和滴定终点
B.图乙是 1mol X2(g)、1mol Y2(g)反应生成 2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和
C.图丙是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
D.图丁是光照盛有少量氯水的恒容密闭容器时容器内O2的体积分数变化曲线,说明光照 氯水有O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
反应I(热裂解):CH3COOH(g)2CO(g)+2H2(g) △H1
反应II(脱羧基):CH3COOH(g)CH4(g)+CO2(g) △H2
已知:反应I的活化能为(E5-E2)kJ,反应I逆反应的活化能为(E5-E3)kJ,反应II的活化能为(E4-E2)kJ,反应II逆反应的活化能为(E4-E1)kJ,E1到E5能量依次增大
(1)△H1+△H2=___________kJ/mol (用有关E的代数式表示);
(2)在不同温度下,向密闭容器中充入等量醋酸蒸汽,反应相同时间后,测得各气体的产率与温度的关系如图所示:

①约650℃之前,氢气产率低于甲烷的原因是;________________________________;
②约650℃之后,随着温度升高后,氢气产率高于甲烷的原因是:___________;(填编号)
a. 反应II速率减慢
b. 反应I速率加快的程度比反应II大
c. 反应I正向移动,而反应II逆向移动
d. 反应I正向移动的程度大于反应II正向移动的程度
③根据图像分析,该容器中一定发生了另外的副反应,理由是:______________。
(3)投入一定量的乙酸,在相同压强下,经过相同反应时间测得如下实验数据:
温度(℃) | 催化剂 | CH3COOH转化率 | H2的选择性 |
550 | 甲 | 14.5 | 40.2 |
550 | 乙 | 11.1 | 62.1 |
600 | 甲 | 11.2 | 41.2 |
600 | 乙 | 10.3 | 63.3 |
(H2的选择性:转化的CH3COOH中生成H2的百分比)
①表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成H2的选择性有显著的影响,其原因是________。
②有利于提高CH3COOH转化为H2平衡转化率的措施有________。
A.使用催化剂甲 B.使用催化剂乙
C.升高反应温度 D.增加反应物的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________。
③FeCl3净水的原理是:___________________________(用离子方程式及适当文字回答);
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。

①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择__________(填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________(填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be和9Be_____________(填序号)。
a.是同一种原子 b.具有相同的中子数 c.具有相同的化学性质 d.互为同位素
(2)写出A1(OH)3与NaOH溶液反应的化学方程式:_________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____________(填序号)。
a.比较Mg(OH)2与A1(OH)3的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
II.下表列出了①~⑩10种元素在周期表中的位置。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为__________。
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式 __________________________
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻羟基苯甲酸(俗名水杨酸)其结构简式为如图所示:

(1)水杨酸既可以看成是_______类物质,同时也可以看成_____类物质。
(2)将其与_______溶液作用生成物的化学式为C7H5O3Na,将其与______溶液作用生成物的化学式为C7H4O3Na2。
(3)水杨酸的不同类同分异构体中,属于酚类且也具有苯环的化合物的结构简式为_______,它还可看成是______类物质。
(4)比水杨酸多一个CH2原子团,且与水杨酸属于同系物的取代基数目不同的物质的结构简式为___。
(5)比水杨酸多一个CH2原子团,且与水杨酸不属于同系物的物质的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以AgZSM为催化剂,在容积为1L的容器中,相同时间下测得0.1molNO转化为N2的转化率随温度变化如图所示[无CO时反应为2NO(g)![]() N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)
N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)]。下列说法正确的是( )
2CO2(g)+N2(g)]。下列说法正确的是( )
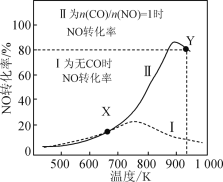
A.反应2NO(g) ![]() N2(g)+O2(g)的ΔH>0
N2(g)+O2(g)的ΔH>0
B.达平衡后,其他条件不变,使![]() >1,CO转化率上升
>1,CO转化率上升
C.X点可以通过更换高效催化剂提高NO转化率
D.Y点再通入CO、N2各0.01mol,此时v(CO,正)<v(CO,逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. pH=1的HCl溶液中,含有0.1NA个H+
D. 0.1mol苯乙烯分子中,含有碳碳双键的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com