
【题目】将镁、铝的混合物共0.2mol,溶于200mL 4molL﹣1的盐酸溶液中,然后再滴加2molL﹣1的NaOH溶液.请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示.当V1=160mL时,则金属粉末中n (Al)=mol 
(2)0~V1段发生的反应的离子方程式为;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL;
(4)若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL 4molL﹣1的硫酸溶解此混合物后,再加入840mL 2molL﹣1的NaOH溶液,所得沉淀中无Al(OH)3 , 则a的取值范围为 .
【答案】
(1)0.08
(2)H++OH﹣=H2O
(3)400
(4)0.6≤a<1
【解析】解:(1)当V1=160mL时,此时,溶液是MgCl2、AlCl3和NaCl的混合液, 由Na+离子守恒可知,n(NaCl)=n(Na+)=n(NaOH)=0.16L×2mol/L=0.32mol,
200mL 4molL﹣1的盐酸溶液中含有氯化氢的物质的量为:4mol/L×0.2L=0.8mol,
设混合物中含有MgCl2xmol、AlCl3为ymol,则:
根据Mg原子、Al原子守恒有:x+y=0.2,
根据Cl﹣离子守恒有:2x+3y=0.8﹣0.32=0.48,
联立方程解得:x=0.12、y=0.08,
所以金属粉末中:n(Mg)=0.12mol、n(Al)=y=0.08mol,
故答案为:0.08;(2)0~V1段,滴入氢氧化钠溶液后没有生成沉淀,说明盐酸过量,滴入的氢氧化钠与氯化氢反应生成氯化钠和水,反应的离子方程式为:H++OH﹣=H2O,
故答案为:H++OH﹣=H2O;(3)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是NaCl溶液,根据Cl﹣离子和Na+离子守恒有:n(Na+)=n(NaCl)=(HCl)=4mol/L×0.2L=0.8mol,
所以需要加入氢氧化钠溶液体积为:V(NaOH)= ![]() =0.4L=400mL,
=0.4L=400mL,
故答案为:400;(4)由于为金属混合物,则a<1,Al的物质的量为:0.2(1﹣a)mol,反应后的混合溶液,再加入840mL 2molL﹣1的NaOH溶液,所得沉淀中无Al(OH)3 , 则溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知:n(NaAlO2)=0.2(1﹣a)mol,
根据钠离子守恒,应满足:n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.84×2≥2×0.2×4+0.2(1﹣a),
解得:a≥0.6,
所以a的取值范围为:故0.6≤a<1,
故答案为:0.6≤a<1.
(1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明盐酸有剩余,滴加的NaOH用于中和剩余盐酸,V1=160mL时,剩余的HCl与滴加的NaOH恰好完全反应,溶液是MgCl2、AlCl3和NaCl混合液,根据Mg原子、Al原子、Cl﹣离子、Na+离子守恒,列方程求算n(Al);(2)0~V1段滴入的氢氧化钠溶液与剩余的氯化氢反应生成氯化钠和水;(3)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是NaCl溶液,根据Cl﹣离子和Na+离子守恒有n(Na+)=n(NaCl)=(HCl)求出n(NaOH),再利用V= ![]() 计算滴入NaOH溶液的体积;(4)反应后的混合溶液,再加840mL 2molL﹣1的NaOH溶液,所得沉淀中无Al(OH)3 , 溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用a表示出n(NaAlO2),据此确定a的取值范围.
计算滴入NaOH溶液的体积;(4)反应后的混合溶液,再加840mL 2molL﹣1的NaOH溶液,所得沉淀中无Al(OH)3 , 溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用a表示出n(NaAlO2),据此确定a的取值范围.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】小明因体内缺乏某种维生素,患了夜盲症,同学们七嘴八舌地给他提供补充该维生素的食谱。下列食品对补充维生素治疗他的夜盲症没有明显作用的是
A.鱼肝油B.水果C.动物肝脏D.豆制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.塑料在自然条件下不易分解,可造成白色污染
B.合成纤维的主要原料可以是石油、天然气、煤和农副产品
C.天然橡胶的性质很稳定,在空气、日光作用下也不会老化
D.塑料、合成纤维和合成橡胶都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组顺序的排列不正确的是
A. 热稳定性:HCl>H2S>PH3 B. 若离子半径:R2->M+,则原子序数一定:R >M
C. 酸性强弱:H2SiO3<H2CO3<CH3COOH D. 熔点:金刚石>食盐>干冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知:①C+、D3+均与E的气态氢化物分子含有相同的电子数;A2-、B-与B的气态氢化物分子含有相同的电子数;②A单质在空气中燃烧产生气体R;③B的气态氢化物与E的气态氢化物相遇时有白烟生成。
请回答下列问题:
(1)元素A在元素周期表中的位置是__________
(2)A、B、C、D的简单离子半径从大到小顺序为______________(用离子符号表示)
(3)B的气态氢化物与E的气态氢化物相遇时生成白烟的电子式为_________,其中所含化学键类型为_____________
(4)D的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为_____
(5)A元素和B元素以原子个数比1:1形成化合物Q,Q的结构式为________
己知Q是种黄色油状液体,常温下遇水易反应,产生R气体,易溶液出现浑浊,请写Q与水反应的化学方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似。相关化学性质如右图所示,下列说法不正确的是
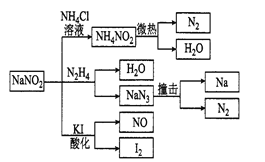
A. NaNO2稳定性大于NH4 NO
B. NaNO2与N2 H4反应中,NaNO2是氧化剂
C. 可用KI-淀粉试纸和食醋鉴别NaNO2和NaCl
D. 分解NaN3盐每产生1 mol N2转移6 mol e一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将乳清蛋白、淀粉、胃蛋白酶、唾液淀粉酶和适量水混合装入一个容器内,调整pH至2.0,保存于37℃的水溶锅中,过一段时间后,容器内剩余的物质是
A.淀粉、胃蛋白酶、多肽、水
B.唾液淀粉酶、淀粉、胃蛋白酶、水
C.唾液淀粉酶、胃蛋白酶、多肽、水
D.唾液淀粉酶、麦芽糖、胃蛋白酶、多肽、水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
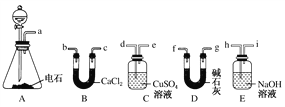
(1)A中制取乙炔的化学方程式为_________________________________。
(2)制乙炔时,旋开分液漏斗的活塞,使水慢慢滴下的原因是_________________。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用________(填序号,下同)装置,干燥乙炔最好选用________装置。
(4)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
纯净乙炔气![]() 混合液
混合液![]() 有机混合物Ⅰ
有机混合物Ⅰ![]() 混合液
混合液![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com