
分析 经5min达到平衡,此时生成C为2mol,v(C)=$\frac{\frac{2mol}{4L}}{5min}$=0.1mol/(L•min),测定D的平均反应速率为0.1mol/(L•min),反应速率之比等于化学计量数之比,x=2,则
3A(g)+B(g)?2C(g)+2D(g),
开始 6 5 0 0
转化 3 1 2 2
平衡 3 4 2 2
结合转化率=$\frac{转化量}{开始量}$、c=$\frac{n}{V}$、压强比等于物质的量比计算.
解答 解:经5min达到平衡,此时生成C为2mol,v(C)=$\frac{\frac{2mol}{4L}}{5min}$=0.1mol/(L•min),测定D的平均反应速率为0.1mol/(L•min),反应速率之比等于化学计量数之比,x=2,则
3A(g)+B(g)?2C(g)+2D(g),
开始 6 5 0 0
转化 3 1 2 2
平衡 3 4 2 2
(1)v(C)=$\frac{\frac{2mol}{4L}}{5min}$=0.1mol/(L•min),v(D)=0.1mol/(L•min),速率之比等于化学计量数之比,所以2:x=0.1mol/(L•min):0.1mol/(L•min),解得x=2,
答:x的值是2;
(2)参加反应的B的物质的量n(B)=$\frac{1}{2}$×2mol=1mol,所以B的转化率为α=$\frac{1mol}{5mol}$×100%=20%,
答:B的转化率为20%;
(3)△n(A)=$\frac{3}{2}$×2mol=3mol,n(A)平衡=n(A)起始-△n(A)=6mol-3mol=3mol,所以c(A)平衡=$\frac{3mol}{4L}$=0.75mol/L,
答:平衡时A的物质的量浓度为0.75mol/L;
(4)3A(g)+B(g)?2C(g)+2D(g),即反应前总的物质的量相等,根据压强之比等于物质的量之比,故恒温达平衡时容器内的压强与开始时压强比为1:1.
答:恒温达平衡时容器内的压强与开始时压强比为1:1.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意速率与化学计量数的关系、压强与物质的量的关系,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
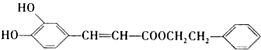 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: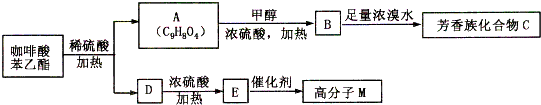
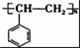 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数目为NA | |
| B. | 6.4g的S2和S8混合物中,含硫原子总数为0.2NA | |
| C. | 0.1 mol•L-1的NaHSO4溶液中含有阳离子的总数为0.2NA | |
| D. | 7.8 g Na2O2与水反应,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
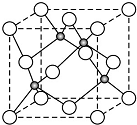 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: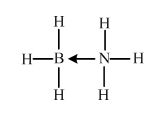 (必须标明配位键)
(必须标明配位键)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
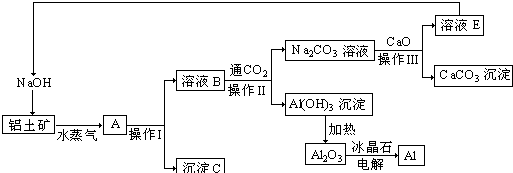
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
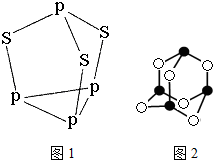 磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.
磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com