
| A. | 海洋约占地球表面积的71%,所以地球上不缺水 | |
| B. | 海水淡化蒸馏法的成本最低 | |
| C. | 海水淡化的主要方法有蒸馏法、电渗析法和离子交换法等 | |
| D. | 以上说法都正确 |
分析 A、地球上水的总量大约有1.4x109km3.但这些水中有97.5%是海水,与我们平常生活关系最为密切的淡水只有3.5x107km’,占总水量的2.5%;
B.蒸馏时需要大量的热量;
C.海水淡化水,应将水与盐分离,目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法、电渗析或离子交换法等等,其中最常用的是蒸馏法,目前多采用多级闪急蒸馏法,电渗析或离子交换法等;
D.根据ABC选项的分析判断是否正确;
解答 解:A、地球上的水量虽大,可供我们人类直接利用的水并不多.但是淡水资源非常紧张,海洋中的水,由于成份复杂,含盐量高,无法直接使用.人类面临的有限的淡水资源日益减少,我国至少有一半以上的省份处于严重缺水状态,我国是世界上13个严重缺水的国家之一,不能随意使用水资源、浪费水,故A错误;
B.蒸馏时需要大量的热量,成本较高,经济效益差,故B错误;
C.海水淡化的主要方法有蒸馏法、电渗析法、离子交换法,故C正确;
D.上述说法中只有C正确,故D错误;
故选C.
点评 本题考查了海水资源的综合应用、海水淡化的方法分析判断、重金属离子的除杂等知识点,注意知识的积累,题目题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期、18个族 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 工业上常用电解NaCl水溶液的方法制取金属钠 | |
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.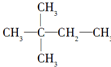 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
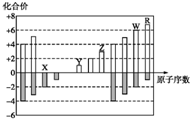
| A. | 离子原子半径:X2->Y+>Z3+ | |
| B. | 气态氢化物的沸点:X>R | |
| C. | 最高价氧化物的水化物的酸性:W>R | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
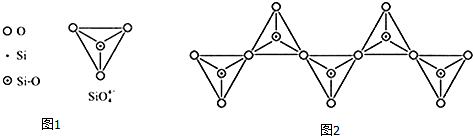
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com