
(1) ②④⑥;100mL容量瓶 玻璃棒;; (2) 5.4;①;(3)偏低;偏高
解析试题分析:(1)配制100 mL 1 mol/L的稀硫酸时,上述仪器中需要使用的有①胶头滴管;③烧杯;⑤量筒,不需要使用的仪器是②烧瓶;④ 药匙;⑥托盘天平。(2)浓硫酸的物质的量浓度是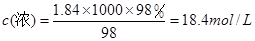 溶液在稀释前后溶质的物质的量不变,18.4mol/L×V= 100ml×1mol/L.解得v= 5.4ml即浓硫酸的体积为5.4ml。量取浓硫酸时应选用规格与量取的体积接近的量筒,选用①10mL规格的量筒;(3)①配制过程中,若将洗涤烧杯所得的溶液直接倒入废液缸中,则会因为溶质的损失导致最后所得溶液的浓度偏低;②定容时俯视容量瓶的刻度线,则由于溶液的体积少所配得的溶液浓度偏高。
溶液在稀释前后溶质的物质的量不变,18.4mol/L×V= 100ml×1mol/L.解得v= 5.4ml即浓硫酸的体积为5.4ml。量取浓硫酸时应选用规格与量取的体积接近的量筒,选用①10mL规格的量筒;(3)①配制过程中,若将洗涤烧杯所得的溶液直接倒入废液缸中,则会因为溶质的损失导致最后所得溶液的浓度偏低;②定容时俯视容量瓶的刻度线,则由于溶液的体积少所配得的溶液浓度偏高。
考点:考查物质的量浓度的溶液的配制使用的仪器的选择、误差分析、与溶液的质量分数的换算的知识。


科目:高中化学 来源: 题型:单选题
设NA为阿伏伽德罗常数的值,下列说法中正确的是
| A.常温常压下,11.2L的NO2和CO2混合气体含有NA个O原子 |
| B.标准状况下,22.4L的乙烯中含有的共用电子对数为12NA |
| C.1L0.1mo1·L-1的氨水中含有0.1NA个OH- |
| D.以石墨为电极电解氯化铜溶液时,若阳极上失去电子NA个,则阴极质量增加32g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.4.2 g丙烯中所含的共价键数目为0.6×6.02×1023 |
| B.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023 |
| C.相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 |
| D.相同物质的量OH-和CH3+含有相同数目的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
浓H2SO4密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1).若C=9.2则a>10 b>49% (2) 若C=9.2则a>10 b<49%
(3).若b=49则a=18.4 C<9.2 (4) 若b=49则a=18.4 C>9.2
| A.(1) (3) | B.(1) (4) | C.(2) (3) | D.(2) (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变,试求:
(1)原混合物中Fe2O3的质量为 ;
(2)原盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率 。
(2)2s时A的物质的量浓度为 。
(3)2s时B的物质的量为 。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶。
(2)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)①48 g RO42-中,核外电子总数比质子总数多6.02×1023个,则R原子的摩尔质量为 。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为 。
(2)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为 ;
②所得溶液中Cl-的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室需用90mL 2mol·L-碳酸钠溶液。
(1)配制该溶液时,根据你的实践经验,下列仪器不可能用到的是_____(填选项)。
A. 托盘天平 B. 烧杯 C. 胶头滴管 D. 100ml容量瓶 E. 90ml容量瓶 F.玻璃棒
(2)实验操作步骤有:A.称取碳酸钠晶体;B.用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶;C.将烧杯中的溶液转移到选定的容量瓶中;D.将碳酸钠晶体置于烧杯中用适量的水溶解,并用玻璃棒搅拌均匀;E.将配好的碳酸钠溶液装入试剂瓶待用并贴好标签;F.向容量瓶加水至刻度线1-2cm处改用胶头滴管滴加水至液面与刻度线相切;G.塞好瓶塞,反复上下颠倒摇匀。
①上述步骤的正确操作顺序是 B (填写字母)
②本实验称取的碳酸钠晶体的质量是 g
③若定容时仰视刻度线,则所配溶液浓度 (填“偏大”、“偏小”或“无影响”)
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理方法是 (填选项)。
A. 吸出多余液体,使凹液面与刻度线相切
B. 小心加热容量瓶溶液,经蒸发后,使凹液面与刻度线相切
C. 经准确计算加入一定量的浓硫酸
D. 重新配制碳酸钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com