
【题目】在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中氧化剂与还原剂物质的量之比为( )
A.1:8
B.8:1
C.1:5
D.5:1
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】V mL硫酸铝溶液中含Al3+a g,取V/4 mL溶液稀释到4V mL,稀释后溶液中SO42-的物质的量浓度是
A. 125a/9V mol/L B. 125a/18V mol/L
C. 125a/36V mol/L D. 125a/54V mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.4molL﹣1 NaOH溶液480mL.配制方法如下:
(1)配制该溶液所需的仪器有:量筒、天平、药匙、烧杯、玻璃棒、___、_____;
(2)用托盘天平准确称量___________g 固体NaOH;
(3)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是_________,对实验结果没有影响的是_____________(填各选项的序号).
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,仰视容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) H= —99kJ.mol—1中的相关化学键键能如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=___________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____v(a)(填“>”、“<”或“=”)。②该反应的△S______0,图中的T1______T2(填“>”、“<”或“=”)。
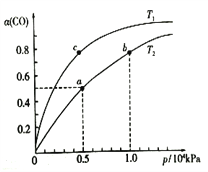
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________。
④图中a点的压强平衡常数KP=_______________(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2
CO(g) + H2O(g) H2
III:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。
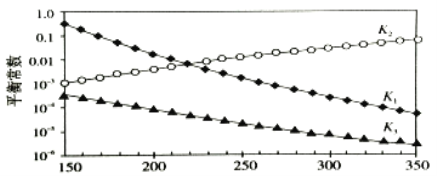
则H1___________H3(填“>”、“<”或“=”), 理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题。
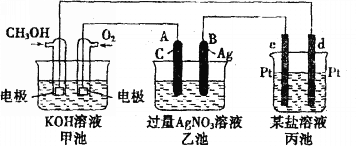
(1)甲池是_________池,通入CH3OH(甲醇)的电极作为_______极,电极反应式为________________________________________________。
(2)乙池是________池,A电极名称为______极,电极反应式为_______________________,乙池中的总反应化学方程式为________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当甲池中消耗O2 0.56L(标准状况下)时,理论上乙池中B极的质量增加_______g;此时丙装置中_____________(填“c”或“d”)电极析出1.20g金属,则丙装置中的某盐溶液可能是________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液中NH4+和NH3·H2O的物质的量分数φ与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是

A. 表示NH3·H2O物质的量分数变化的曲线是B
B. pH=9.26时的溶液中,NH3·H2O的电离程度小于NH4+的水解程度
C. 常温下,NH3·H2O的电离常数为1.8×10-5mol/L(已知lg1.8=0.26)
D. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5+10-9)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)由萃取后余液获得粗产品的操作步骤为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、NH、I—、CO![]()
B. 0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl—、SO![]()
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO![]() 、AlO
、AlO
D. 水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的一氧化二氮(N2O)和二氧化碳两种气体相比较:①质量相等、②所含碳原子数与氮原子数相等、③所含分子数相等。上述结论中正确的是( )
A. ①②③ B. ②③ C. ①② D. ①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com