
下列离子方程式不正确的是
A.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2═2Fe3++2Cl﹣
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I﹣═2I2+2H2O
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO
D.碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3﹣+2Ca2++4OH﹣═Mg(OH)2↓+2CaCO3↓+2H2O
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:2016届河南省三门峡市高三上学期第二次精英对抗赛化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法不正确的是
A.煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源
B.“84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感
C.已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,则水热反应可以降低自然界中碳的含量
D.已知PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,则PM2.5在空气中有可能形成胶体
查看答案和解析>>
科目:高中化学 来源:2016届河南省洛阳市高三上学期12月统考化学试卷(解析版) 题型:选择题
心脏起搏器一般是给心跳缓慢的病人使用。某种类型的心脏起搏器工作时发生下列反应:4Li+2SOC12 =4LiC1+S+SO2,下列有关判断正确的是
A.还原剂只有锂
B.SOC12中每个原子都达到8电子稳定结构
C.氧化产物包括LiCl和SO2
D.生成1. 12 LSO2时,反应转移电子为0.2 mol
查看答案和解析>>
科目:高中化学 来源:2016届山东省北校高三上学期第二次单元测试化学试卷(解析版) 题型:选择题
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是

A.温度: T1>T2>T3
B.正反应速率:υ(b)>υ(d) υ(a)>υ(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量: M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化学 来源:2016届山东省北校高三上学期第二次单元测试化学试卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图所示:
2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图所示:
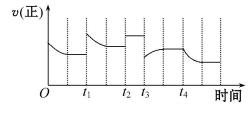
下列说法正确的是
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期11月半月考试化学试卷 (解析版) 题型:实验题
有一混合物的水溶液,只可能含以下离子中的若干种:K+ 、Al3+ 、Fe3+ 、Mg2+ 、Ba2+ 、 NH4+、Cl- 、CO32-、SO42 -,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
③在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
④第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是___________,不能确定是否存在的离子是_____________。
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号______,浓度__________________;
离子符号______,浓度__________________;
(3)试确定K+ 是否存在________(填“是”或“否”),判断的理由是__________。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期11月半月考试化学试卷 (解析版) 题型:选择题
下列有关化学反应过程或实验现象的解释中,正确的是
A.Fe(OH)3胶体中加入Na2SO4溶液后有红褐色沉淀生成,说明胶体是不稳定的分散系
B.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强
C.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第四次质检化学试卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B = H++HB-,HB-  H++B2-
H++B2-
回答下列问题:
(1)Na2B溶液显 (填“酸性”“中性”或“碱性”),理由是 。(用离子方程式表示)
(2)在0.1 mol·L-1 Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(Na+)+(OH-)=c(H+)+c(HB-)
B.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
C.c(Na+)=2c(B2-)+2c(HB-)
D. c(B2-)+ c(HB-)=0.1mol·L-1
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”“>”或”=”),理由是 。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2016届上海市十一校高三上学期12月联考化学试卷(解析版) 题型:计算题
氢气是化工行业重要原料之一。
(1)电解饱和食盐水是生产H2的方法之一。常温下,电解250 mL饱和食盐水一段时间后,溶液质量减轻0.365 g(假设气体全部逸出)。生成的氢气在标准状况下的体积为 mL。
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1 m3 甲烷经此过程生成0.27 m3氢气,则甲烷的裂解率为 %(体积均在相同条件下测定)。
(3)已知:CxHy + H2O → CO + CO2 + H2(未配平)。工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
组分 | CO | CO2 | H2 |
体积分数 | 20% | 5% | 75% |
计算原混合气体中甲烷与乙烷的物质的量之比。
(4)合成氨生产过程中,消耗氮氢混合气2000 m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%。计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com