
Ϊ֤����ѧ��Ӧ��һ�����ȣ���������̽�����
I��ȡ5mL 0.1mol/L��KI��Һ���μ�5��6��FeCl3ϡ��Һ��
��������2mL CCl4���Ǻò����������á�
��ȡ������Һ��õ����ϲ���Һ���μ�KSCN��Һ��
������ȡ25.00mLFeCl3ϡ��Һ����ƿ�У�����KSCN��Һ����ָʾ��������c mol/LKI����Һ�ζ����ﵽ�ζ��յ㡣�ظ��ζ����Σ�ƽ������c mol/LKI����ҺVmL��
��1��̽���I�з�����Ӧ�����ӷ���ʽΪ ��
�뽫̽������С����á���õ��²�Һ��IJ�����������������Һ©����������̨�ϣ����á�
��
��2��̽��������ͼ��ͨ�����ɺ�ɫ����Һ����������ȫ��ΪFe(SCN)3������֤��Fe3+�������Ӷ�֤����ѧ��Ӧ��һ�����ȣ�����ʵ����ȴδ����Һ�ʺ�ɫ���Դ�ͬѧ��������������ֲ��룺
����һ��Fe3+ȫ��ת��ΪFe2+ ����������ɵ�Fe(SCN)3Ũ�ȼ�С������ɫ�������۲졣
Ϊ����֤���룬�������ϻ��������Ϣ��
��Ϣһ����������ˮ���ܶ�Ϊ0.71g/mL��Fe(SCN)3�������е��ܽ�ȱ���ˮ�д�
��Ϣ����Fe3+����[Fe(CN)6]4����Ӧ���ɰ���ɫ��������K4[Fe(CN)6](�����軯��)��Һ����Fe3+�������ȱ���KSCN��Һ���ߡ�
�������Ϣ�����������ʵ�鷽����֤���룺
��������±�
| ʵ����� | ����ͽ��� |
| ����һ�� | ����������ɫ�������� �� |
| ������� | �����Ѳ�ʺ�ɫ���� �� |
����14�֣���1��2Fe3+ + 2I-��2Fe2+ + I2��2�֣�����Һ��ֲ����Һ©�����ϵIJ���������ʹ�������ϵİ��ۣ���С�ף�����Һ©���ϵ�С�ף��ٽ���Һ©������Ļ���š����ʹ�²�Һ���������ձ������¡���2�֣�
��2��ʵ����� ����ͽ��� ����һ��ȡ��ȡ��õ����ϲ���Һ������2��K4[Fe(CN)6](�����軯��)��Һ��2�֣� ����������ɫ�����������һ��������1�֣� �������ȡ̽������������Һ�������������ѣ���������÷ֲ㣨2�֣� �����Ѳ�ʺ�ɫ��������������1�֣�
4Fe3+ +3[Fe(CN)6]4����Fe4[Fe(CN)6]3����2�֣� ��3��0.04cV��2�֣�
���������������1�������Ӿ��������ԣ��ܰѵ������������ɵ��ʵ⣬��Ӧ�����ӷ���ʽ��2Fe3+ + 2I-��2Fe2+ + I2��̽������������Ȼ�̼��ȡ���ʵ⣬�����ȷ�IJ����ǽ���Һ©����������̨�ϣ����á���Һ��ֲ����Һ©�����ϵIJ���������ʹ�������ϵİ��ۣ���С�ף�����Һ©���ϵ�С�ף��ٽ���Һ©������Ļ���š����ʹ�²�Һ���������ձ������¡�
��2���ٸ��ݲ���1��ʵ�������Dz�������ɫ��������˵��������Լ���K4[Fe(CN)6](�����軯��)��Һ�����Բ���1��ȡ��ȡ��õ����ϲ���Һ������2��K4[Fe(CN)6](�����軯��)��Һ������������ɫ�����������һ�����������ݲ���2��ʵ�����������Ѳ�ʺ�ɫ����˵��������Լ������ѣ�����2�IJ�����ȡ̽������������Һ�������������ѣ���������÷ֲ㡣�����Ѳ�ʺ�ɫ��������������
�ڸ������Ϸ�����֪��ʵ�����������һ���еķ�Ӧ���ӷ���ʽ��4Fe3+ +3[Fe(CN)6]4����Fe4[Fe(CN)6]3����
��3�����ݷ���ʽ2Fe3+ + 2I����2Fe2+ + I2��֪
Fe3+����������I��
1mol 1mol
0.0250Lx cmol/L��0.001VL
���x��0.04cVmol/L
���㣺����������ԭ��Ӧ����ʽ����д����ȡʵ�������������ѧʵ�鷽������ƣ����ӵļ����Լ�����Ũ�ȵļ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��1����ѹ390��ʱ�����淴Ӧ�� 2NO2 2NO+O2�ﵽƽ�⣬��ʱƽ����������ܶ�����ͬ������H2�ܶȵ�19.6������NO2�ķֽ��ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2��Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p��CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
[ʵ�����]������p��CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298 K��313 K(����ʵ���������±�)��������¶Ա�ʵ�顣
(1)���������ʵ����Ʊ�(���в�Ҫ���ո�)��
| ʵ���� | ʵ��Ŀ�� | T/K | pH | c/10��3 mol��L��1 | |
| H2O2 | Fe2�� | ||||
| �� | Ϊ����ʵ�������� | 298 | 3 | 6.0 | 0.30 |
| �� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | | | | |
| �� | | 298 | 10 | 6.0 | 0.30 |
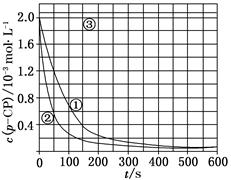
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ��ķ�������̽����
��1��ʵ��һ��ȡ�����ʵ���Ũ�ȵ����H2O2��Һ�ֱ��������ʵ�飬ʵ�鱨�����±���ʾ��
| ��� | ���� | ���� | ���� | |
| �¶�/�� | ���� | |||
| 1 | 40 | FeCl3��Һ | | |
| 2 | 20 | FeCl3��Һ | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | �� | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij��ѧʵ��С���ͬѧ������������װ������ȫ��ͬ��װ�ö���̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣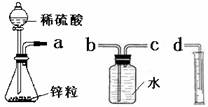
��1��Ϊ�ﵽ��ʵ��Ŀ����װ������˳��Ϊ��a��________��________��________.
��2�����Ӻ�װ�ú����һ��������
��3����ƿ�з�����Ӧ�����ӷ���ʽΪ
��4������װ�õķ�Һ©����װ���Լ��ֱ�Ϊ1mol/L�����4mol/L����,��С��ͬѧҪ�ⶨ����¼���������±���
| ������Լ� | H2���������ͬ�����£� | ��Ӧʱ�� | ��Ӧ���� |
| 1mol/L������ | 10mL | t1 | v1 |
| 4mol/L���� | 10mL | t2 | v2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
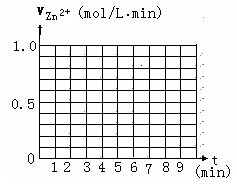
ij��ѧѧϰС���������װ��(�г�װ������)������Լ����Բ���������O2������ٷ�����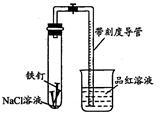
(1)ʵ��ǰ�ü�Һ��ϴ����������0��100mol/L��H2SO4��Һ�����������ݲ�������H2SO4��Һ���ݵ�Ŀ����_____ ��
(2)Ϊ������С�����в�������ȷ˳����______ (����ţ���
��װ�������ڲ���ע��������������������� NaCl��Һ����ֹˮ�Т۽����ܿڽ���Ʒ����Һ���� �ϵ������ݼ��װ��������
(3)ʵ�����Թ��ڷ������ܷ�ӦΪ__ ____ ���ø�ʵ�鷽������������O2������ٷ���ʱӦ�����������ǣ��ٵ������Թ��ڲ��ռ����������______ ��
(4) ʵ��ʱ������������������Ӧ������ʱ�ϳ�������Ӱ�����������·������벹�� д����������
����һ���������Һ��PH��ͬ
�����:NaCl��Һ��Ũ�Ȳ�ͬ
��������
(5)��������ʵ��װ�ã�ͨ��������Һ��pH��֤����һ�����������ʵ�����ݣ�
�ٵ�pH=2ʱ��û�й۲쵽�ȶ�Һ���γɵ�ԭ����__ ____
�ڸ���ʵ�����ݷ�����Ϊ����ʵ��ⶨʱ�䣬pH����ѷ�Χ��______
�۰�����ʵ��װ�ã����ʵ��֤���������
��һ����___________ ��
�ڶ���:����ͬ�¶��£�����ϵͳ���������������װ������ȫ��ͬ������װ�ã��ֱ���ע������NaCl��Һ�����������棻
����������¼�γ��ȶ�Һ������ʱ���Һ���ĸ߶ȣ��ȽϷ������ݵó����ۡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���0.1mol/L��̼������Һ�У���������Ũ�ȵĹ�ϵʽ��ȷ����
A��2c(H2CO3)+c(HCO )+c(H+) = c(OH��) )+c(H+) = c(OH��) |
B��c(Na+) = c(HCO )+c(H2CO3)+ 2c(CO )+c(H2CO3)+ 2c(CO ) ) |
C��c(Na+)��c(H+)��c(OH��)��c(CO ) ) |
D��c(Na+)+c(H+) = c(HCO )+c(OH��)+ 2c(CO )+c(OH��)+ 2c(CO ) ) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���б����У��������ǣ� ��
| A����ˮ���ȣ�Kw���䣬pH���� |
| B����FeCl3��ˮ��Һ�������ɿɵõ�FeCl3���� |
| C����25 mL��ʽ�ζ�����ȡ20.00mL���������Һ |
| D���ö��Ե缫���������AgNO3��Һʱ������0.2 mole-ת��ʱ������21.6g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ����0.1mol��L��1��ˮ��Һ��ˮϡ�ͣ�������ֵ������
| A��c(OH��) | B��pH | C��c(NH4+)/c(NH3��H2O) | D��c(H+)��c(OH��) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com