
Ⅰ、工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产过程中会产生沉淀氢氧化铁,用来制取FeCO3的流程如下:
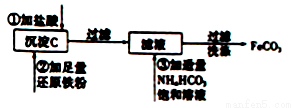
完成上述转化过程中的离子方程式
①____________________________。
②____________________________。
Ⅱ、有一瓶澄清溶液,其中可能含有可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-。取该溶液进行以下实验:
(1)填写表中开空白:
实验步骤 | 肯定不存在的离子 |
①用PH试纸检验,溶液呈强酸性 | |
②取出部分溶液,加入少量CCl4和数滴新制氯水,振荡,精置CCl4层呈紫红色 | |
③另取出部分溶液,向其加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成 |
(2)根据以上事实,该溶液中肯定存在的离子是_________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 14 | C. | 12 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、盐酸 | B. | NaOH溶液、CO2 | ||
| C. | NaHCO3溶液、石灰水 | D. | Na2O2、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:推断题
[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3

查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
某同学用图Ⅰ所示的装置验证一些物质的性质。下列说法错误的是
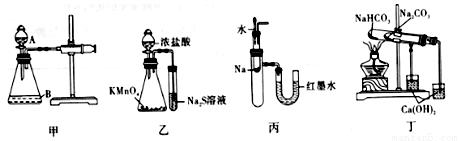
A.图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
B.图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱
C.将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升
D.图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列实验可实现检验或鉴别目的的是
A.根据反应MnO4-+5Fe2++8H+=Mn2-+5Fe3++4H2O可知,用酸性KMnO4溶液可检验FeSO4.7H2O是否变质
B.用CO2鉴别NaAlO2溶液和CH3COONa溶液
C.用湿润的碘化钾淀粉试剂鉴别Br2(g)和NO2
D.用KOH溶液鉴别SO3(g)和SO2
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀硝酸,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | 铝箔插入稀硝酸中 | 无现象 | 铝箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:填空题
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。请回答下列问题:
(1)与氧同周期的相邻的元素中,第一电离能由大到小的顺序为________________。(填元素符号)
(2)气态SO3分子的空间构型为______________;与其互为等电子体的阴离子为___________(举一例)。
(3)将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图,此固态SO3中S原子的杂化轨道类型是_____________。
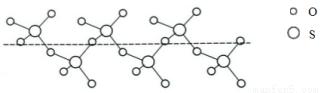
(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为_________(填元素符号);X的基态原子的电子排布式为___________________。
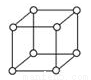
(5)单质钋是由___________键形成的晶体;有资料表明,只有钋的晶体中的原子具有如图所示的堆积方式,若已知Po的摩尔质量为M g·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为____________g/cm3。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省琼海市高一上学期第一次月考化学试卷 题型:实验题
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下所示(用于沉淀的试剂稍过量):
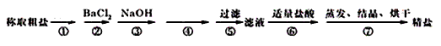
(1)检验粗盐中存在SO42-的方法是(用化学方程式表示)_______________,第①步操作的名称是______________。
(2)第④步中加入试剂的化学式为_____________________。
(3)第⑦步操作所需要玻璃仪器的名称是___________。
(4)若⑤步、第⑥步顺序颠倒,将对实验结果产生影响,其原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com