
【题目】下列反应中,盐酸只作氧化剂的是( )
A.Zn+2HCl = ZnCl2+H2↑B.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Cl2+H2O = H++Cl–+HClOD.CaCO3+2HCl=CaCl2+CO2↑+H2O
科目:高中化学 来源: 题型:
【题目】(1)在某一化学反应中,反应物B的浓度在5s内从2.0mol/L变成0.5mol/L,在这5s 内B的化学反应速率为多少______?
(2)一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余 6.8mol,这种反应物的化学反应速率为多少_________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出CO2的空间构型:___________。
(2) 写出Na3N的电子式:____________________。
(3) 写出C2H6O的化学名称:______________________。
(4) 写出乙烯的实验式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
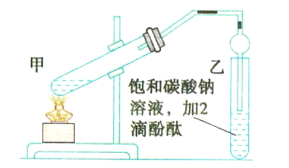
(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中球形管的作用是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图流程可制备1,4-环己二醇,试回答:
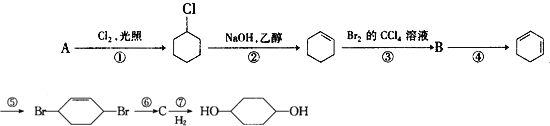
(1)反应①、②、③分别属于___、____、___。(填反应类型)
(2)化合物![]() 中所含官能团的名称为_______和________。
中所含官能团的名称为_______和________。
(3)写出下列化合物的结构简式:A_________,C________。
(4)反应④所用的试剂和条件为_________________。
(5)写出下列反应的化学方程式:反应①_____________;反应④_______________。
(6)请写出以CH3CH2Br为原料制备HOCH2CH2OH的合成路线流程图[无机试剂任用,合成路线流程图示例见本题]。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理被广泛地应用于生产、生活的许多方面。
I.制备氯气
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

(1)此过程中能量转化形式为_____转化为_____(填“化学能”或“电能”)
(2)电极乙为_____(填“阴极”或“阳极”),A 口生成的气体是_____
(3)电解饱和食盐水的离子方程式是 _____
(4)下列有关氯气的说法中正确的是_____
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
II.金属防护
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

(5)被腐蚀的是包裹_____的铁钉(填“锌片”或“铜片”)
(6)结合电极反应式解释 i 中现象产生的原因_____
(7)结合以上实验,请对铁制零件的使用提出建议_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨技术反应原理为:N2 (g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
(1)T ℃ 时,反应达到平衡,测得 υ(NH3)=0.12 mol·L-1·min -1
① υ(N2)=____mol·L-1·min -1
② 化学平衡常数表达式 K=_____
(2)在其他条件相同时,图为分别测定不同压强、不同温度下,N2 的平衡转化率。

L 表示______,其中 X1______ X2(填“>”或“<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
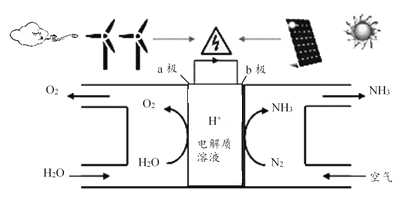
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
![]()
以下推断不合理的是( )
A. 热空气能吹出溴是利用溴易挥发的性质
B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C. 流程中循环利用的物质有SO2、Br2、Cl2等
D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com