
下列关于离子反应及离子共存的说法中正确的是
A.能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存
B.钢铁发生吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O
C.常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存
D.NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
D
【解析】
试题分析:A.能使甲基橙显红色的溶液显酸性,在酸性溶液中Fe2+、与NO3-发生氧化还原反应,不能大量共存,A错误;B.钢铁发生吸氧腐蚀的正极反应:O2+4e-+2H2O=4OH—,B错误;C.常温下,由水电离的c(H+)=10-12mol/L的溶液中水的电离平衡被抑制,则溶液可能显酸性页可能显碱性。如果显酸性则SiO32-、HCO3-均不能大量共存。如果显碱性,则碳酸氢根离子不能大量共存,C错误;D.NaHCO3溶液中滴入少量Ca(OH)2溶液生成碳酸钙、碳酸钠和水,即离子方程式为Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,D正确,答案选D。
考点:考查离子共存与离子方程式正误判断


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.若在原电池中进行,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.改变压强,平衡不发生移动,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol溴苯中含有双键的数目为0.3NA
B.0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA
C.5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA
D.标准状况下,11.2L 由H2和CO组成的混合气体中含有分子的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
分子式为C3H2Cl6的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去的离子有______、_______。
②盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③过程VI中,产品NaOH在电解槽的______区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:填空题
(14分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
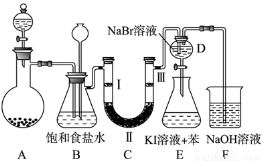
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: 。装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为 色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式: 。
(5)如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气 0.06 mol。(填“大于”“小于”“等于”),若有17.4 g的MnO2被还原,则被氧化的HCl的质量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:选择题
常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是

A.HA为弱酸
B.该混合液pH>7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
“白色污染”的主要危害是:
①破坏土壤结构 ②降低土壤肥效 ③污染地下水 ④危及海洋生物的生存
A.①② B.②③ C.①②③④ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com